百家秘籍
撥開云霧見月明——英捷iBright FL1500 Western熒光成像分析儀技術特點解析-3
Western成像的iBright FL1500 Universal Mode方案
Western Blot實驗流程中,SDS-PAGE凝膠和免染膠、凝膠與Blot、ECL Blot與熒光Blot之間檢測成像原理和方法不盡相同。
凝膠無論用麗春紅S、考馬斯亮藍染色,通常要用紫外-白光轉換屏(疊放于紫外透射臺上組合使用,將紫外線轉換為白光)或LED白光板(自帶電源接口,發光效率高、照明均勻,對低豐度條帶分辨靈敏度高),白光從凝膠底部透射進行成像。凝膠覆蓋區透射白光會因凝膠和樣品吸收和散射作用,亮度減弱。但在凝膠覆蓋區外,白光直射進入成像單元。若曝光時間較長,極易因CCD像元電子阱容量飽和而發生光電子外溢、污染圖像成像區,使圖像失去定量分析價值。不僅透射光如此,采用反射白光檢測應用中,若樣品反射白光過強,同樣會出現圖像局部過度曝光現象。為此,iBright FL1500預裝有針對400-700 nm波長可見光的中性密度濾光片(Neutral density filter, ND filter),以降低LED反射光強度,避免反射光成像過曝風險。
蛋白印跡ECL檢測須排除一切外來光源干擾。這使得蛋白凝膠、蛋白Blot成像的操作互不兼容,無法同時進行。因此,以印跡微弱光信號檢測為首務的Western成像系統,白光屏或白光板均非必備附件。可喜的是,iBright FL1500的標配附件含有LED白光板!
除去亮考、銀染這類非特異性染色法,用SYPRO Ruby蛋白凝膠染色劑、No-Stain免染蛋白熒光標記試劑處理凝膠的成像分析,也是樣品總蛋白定量的常用手段。
SYPRO Ruby熒光成像,既可用伯樂ChemiDoc MP、ChemiScope 6200這類標配302nm紫外透射光源的Western 成像儀進行,也可以依托iBright FL1500、iBright CL750和iBright CL1500(包括iBright CL1000)配備的488nm LED透射光源完成。為防止白光干擾熒光信號采集,凝膠樣品的熒光檢測和凝膠透射、反射白光分析也不可同時實施。
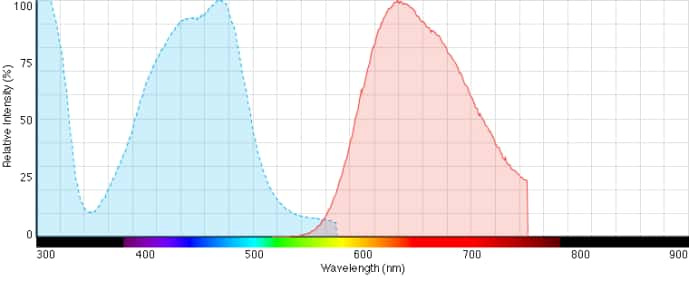
正是Western Blot實驗流程中凝膠和印跡樣品,透射與反射光運用、熒光與發光等不同檢測方法之間的相互沖突,催生了多功能智能化Western成像系統。
1、iBright FL1000代表的Western多模式成像解決方案
iBright FL1000是invitrogen iBright FL1500的上一代產品,2017年上市。
為解決Western Blot多步驟、多種標記成像需求,iBright FL1000系統開發了4種成像模式。
表1. iBright FL1000系統四種成像模式
成像模式 | 適用的樣品類型 |
核酸凝膠模式 (Nucleic acid gels) | 對熒光染料標記的核酸(DNA、RNA)凝膠的成像模式,適用于: Ethidium Bromide, SYBR Safe, SYBR Green、SYBR Gold熒光染料 |
蛋白質凝膠模式 (Protein gels) | 用于染色或熒光標記的蛋白質凝膠檢測,包括: Colorimetric staining of gels (e.g., 考馬斯染色和銀染的蛋白質凝膠) membranes (e.g., Ponceau S, Pierce Reversible Protein Stain); fluorescence staining of gels (e.g., 免染熒光標記和SYPRO標記蛋白凝膠) |
蛋白印跡發光模式 (Chemi Blots) | 用于蛋白印跡化學發光信號的檢測,適用于: Chemiluminescence with HRP and AP substrates (e.g., SuperSignal and Invitrogen Western Breeze substrates) |
蛋白印跡熒光模式 (Fluorescent blots) | Fluorescence with visible and near-infrared (near-IR) fluorophores (e.g., Alexa Fluor and Alexa Fluor Plus dyes and DyLight dyes) |
新手上機,只需根據測試樣品選擇一種成像模式,并確定白光板的取舍、完成樣品的擺放,余下的操作,從照明的開啟,激發和檢測濾光片的配置實用、樣品的自動聚焦、曝光時間的掌控,全部由系統智能管理。
如選擇[Fluorescent blot]進行單色或多色熒光成像,只需幾步簡單操作:
1)點擊染料通道dye channel鍵,調出可選染料列表;
表2 iBright FL1000系統熒光檢測通道
?Excitation Filter / Emission Filter | List of compatible Alexa Fluor Plus dyes |
EX1 455–485nm / EM1 510–555nm | Alexa Fluor Plus 488 |
EX2 515–545nm / EM2 565–615nm | Alexa Fluor Plus 555 |
EX3 610–635nm / EM3 675–720nm | Alexa Fluor Plus 647 |
EX4 655–680nm / EM4 725–750nm | Alexa Fluor Plus 680 |
EX5 745–765nm / EM5 810–850nm | Alexa Fluor Plus 800 |
2)從列表中選擇二抗的標記染料對應的檢測通道(EX3和EX4為二選一);
3)為染料選一種色彩(系統將把不同染料標記的條帶以偽彩色效果顯示和區分)、設定曝光時間;
4)確認完成一個熒光檢測通道的成像條件設置;
5)重復上述4步操作,直至完成其余熒光通道的設置;
6)點擊[Capture]啟動圖像的采集協議。
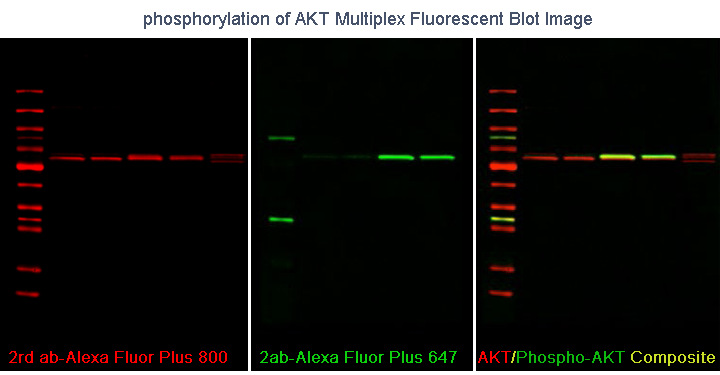
討論iBright FL1000系統的[Fluorescent blot]成像模式,是因為這個模塊具有其它三種應用模式所不具備的一個圖像處理功能——多通道圖像疊加功能。
在熒光Blot成像模式下,系統首先通過不同顏色檢測通道分別采集相應波長熒光的圖像,所有圖像采集完成后,以2UP(Universal Mode Preview, UP)圖像預覽界面顯示全部圖像:預覽區上部顯示所有檢測通道獲取的黑白圖像,預覽區下部是將同一塊Blot上在不同熒光通道獨立采集、分別添加了選定的偽彩色后的由多個通道圖像疊加產生的渲染圖,便于研究者直觀檢視、對比各靶蛋白條帶的信號。
熒光Blot模式下多通道圖像疊加功能,在ECL印跡檢測中不適用。但Western實驗結果發表、匯報時,提供Marker、TPN方法驗證的圖片證據,無疑使數據和分析結果更詳實可信。譬如,將蛋白分子Marker序列圖像、ECL檢測法或多色熒光標記檢測的靶蛋白條帶圖像和(或)連同熒光方法總蛋白檢測圖像合并疊加到同一張圖片上。因此,iBright FL1000雖滿足了Western Blot實驗多個環節、多方法成像功能的需求,但無法將同一Blot不同成像模式下獲取的圖像整合,沒有解決蛋白Blot樣品分析過程重要圖像信息的碎片化問題。
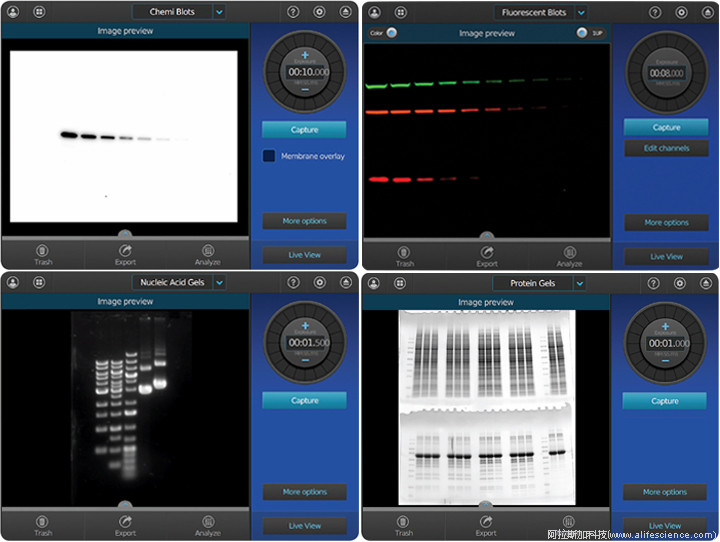
因此,iBright FL1000成像系統盡管實現了多種應用模式智能化控制,使用中還依然存在不便。首先,相較于常規蛋白凝膠染色圖像,大量發表的蛋白Blot圖像中,只見靶蛋白條帶缺少分子量Marker序列條帶驗證信息。其次,部分實驗人員反映,采集的蛋白Blot圖像中,分子量Marker條帶與靶蛋白顏色深淺相反、不一致。這些Western成像和分析中的經典煩惱,隨著iBright FL1500系統Universal Mode的應用而得到了完美解決。
2、Universal Mode的Western成像解決方案
iBright FL1500的Universal Mode(通用模式),官方定義為:
Custom Mode to image samples containing one or more signal types, such as chemiluminescence, fluorescence, colorimetric stains, and/or visible images; image display is similar to fluorescent blot mode and allows one to assign false color to any sample.
就是說,這種自定義成像模式,能對包含有一種或多種信號類型(化學、熒光和/或可見光)的同一個樣品別按設定的成像模式、光學通道和工作先后順序完成多中模式圖像的采集,并自動將這些各自獨立的圖像疊加成一張圖,再加上漂亮的偽彩色渲染后呈現。而所有原始圖像和疊加圖像均可保存和輸出。
通用成像模式適用于iBright FL1500與iBright CL1500,但iBright CL750除外。
討論iBright FL1500通用成像模式前,首先明確2個基本概念。
第一,無論蛋白凝膠考染、蛋白Blot麗春紅S染色,CCD曝光所采集的光學信號均非樣品本身發射,是入射白光接觸樣品時被吸收、散射或反射后的結果。從條帶區始發進入CCD的信號要弱于從條帶毗鄰區背景始發的信號,使CCD輸出的是黑帶白底圖像。而蛋白凝膠或印跡,無論ECL或熒光標記、檢測光源是透射抑或反射,CCD成像信號都源于樣品自身發射,樣品豐度越高,發光基團量子效率越高,則CCD輸出的亮帶暗底圖像上條帶越發明亮。
第二,Western成像系統采集的圖像,與經實驗人員處理后用于發文匯報所用圖像,本質等效而條帶-背景黑白對比呈現效果相反(具體原因,參考《光密度值和灰度值如何在Western Blot條帶定量和凝膠圖像分析中應用? 》)。不管marker、總蛋白、靶蛋白和管家蛋白條帶的成像機制如何,習慣上最終都要人為地“歸一化”轉為黑條帶白背景的發表圖片效果。
iBright FL1500通用成像模式將熒光、發光、反射/透射白光這些互不兼容的檢測程序融為一體,達到井水不犯河水般和諧,靠的是對應用的時序管理。本質是讓實驗人員綜合權衡靶蛋白檢測方法、分子量Marker類型和條帶信號強度歸一化方法后,依托系統個智能化檢測通道成像控制功能,把對系統資源利用存在沖突的成像任務按信號檢測的緊迫程度進行排隊后,由成像系統動執行實驗協議。通用成像模式DIY編程模塊,實現了蛋白Blot成像過程一鍵完成。
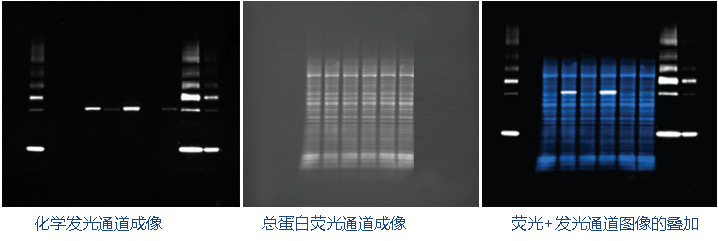
我們以Western實驗檢測AKT信號轉導通路中磷酸化p-AKT水平檢測為例,了解一下通用成像模式的操作流程。實驗中以IGF-1誘導腫瘤細胞的AKT磷酸化,采用化學發光檢測 (SuperSignal West Femto)。No-Stain 蛋白標記試劑標記所有條帶總蛋白(用于執行TPN處理)。分子量Marker用的是iBright prestained marker (化學發光檢測)。完成二抗孵育后在iBright FL1500上采用通用成像模式檢測。
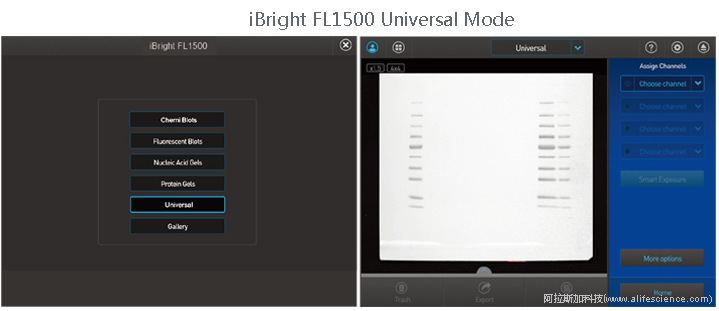
檢測協議的主要設定步驟包括:
① 選通用成像模式
② 選Chemi blots通道下SuperSignal West Femto底物(化學發光法完成(AKT、marker檢測)
③ 選擇TPN No-Stain通道下的No-Stain Labeled Membrane應用(熒光通道完成總蛋白檢測)
④ 確定點擊圖像捕獲按鈕
在通用成像模式下,系統將按設定的順序分階段完成所有檢測通道的圖像采集。
在2UP圖像預覽界面,系統將不同檢測通道下獲取的帶marker的AKT化學發光原圖、總蛋白熒光原和兩個檢測通道圖像疊加后的圖像分別顯示。
3、小結
通常,在核酸、蛋白凝膠圖像中,分子量Marker序列條帶是座上客(占據左側第一泳道位置),用于指示目標條帶的分子量范圍。Western Blot實驗按理也應遵守同樣的報告規則,但實際執行情況并非如此,主要是兩方面的原因造成的。
商品化的蛋白分子Marker,無論是用戶自染型、出廠預染型、Stain-free免染型、熒光標記型,還是化學發光標記型,marker都具有清晰的條帶外形、適宜的條帶亮度和穩定的批次重復性。即便Marker與條帶都用ECL發光標記、在同一Blot上同步添加底物和上機檢測,目標蛋白條帶,特別是低表達靶蛋白,也難以企及marker捷足先登的優秀表現。當Marker和高表達蛋白條帶信號進入系統的線性檢測范圍,甚至要過曝超出系統線性范圍極限了,都不見弱信號條帶現身。因此,實驗中常進行裁膜,將靶蛋白泳道與marker條帶分開,單獨孵育和上機檢測。不同Blot膜條轉移效率存在誤差、上樣時擺放位置和對齊角度的偏差、系統自動曝光控制下曝光時間的差異等,使同一Blot實驗生成最終報告圖片,不是一張完整的mini膜,而是若干獨立小裁條的拼圖,蛋白條帶信號強弱、條帶位置和形狀及圖像背景表現各異。而常規成像控制軟件的圖片合并功能模塊又難以有效適應蛋白Blot圖像整合的要求。這就造成了Western 蛋白印跡報告圖中的種種“合理”現狀。
Invitrogen為iBright成像分析儀開發的Universal Mode通用成像控制模式,通過軟件對不同檢測光學通道成像的時序管理、成像區域的設置,可對同一個轉印膜進行多輪次、多方法、多目標和多圖片采集(可以分批次上樣和成像),并能對控制協議下全部Western Blot實驗要素的圖像提供整合、疊加顯示功能,為研究人員帶來美輪美奐、絢麗多彩的WB夢幻之圖。
通用成像控制模式實現對蛋白印跡各要素、熒光、發光、可見光成像等多種檢測方法在同一塊Blot上的全覆蓋、大融合,又具有各獨立成像控制模式的圖像分析功能。Universal Mode只適用于iBright FL1500、iBright CL1500兩個型號。
參考文獻:
[1]iBright CL1500 Imaging System and the iBright FL1500 Imaging System USER GUIDE Rev B.0
[2]ImageJ User Guide (IJ 1.46r)















