百家論壇更多分類
百家秘籍
撥開云霧見月明——英捷iBright FL1500 Western熒光成像分析儀技術(shù)特點(diǎn)解析-2
一、Western Blot條帶定量分析引入TPN方法的必要性
Western Blot實(shí)驗(yàn)操作的多個(gè)步驟都可能存在誤差,如樣品稀釋濃度和上樣移液體積誤差,蛋白轉(zhuǎn)膜效率差異等。為使蛋白印跡條帶間的信號強(qiáng)度差異,能準(zhǔn)確反映出樣品間的蛋白質(zhì)表達(dá)水平差異,需要對Blot各泳道中條帶的有效信號強(qiáng)度值進(jìn)行歸一化(Normalization)處理。歸一化處理通常是三步進(jìn)行。首先,對每個(gè)泳道所有蛋白條帶做扣除背景操作獲得各條帶的有效信號強(qiáng)度值。第二步,從印跡上選擇一個(gè)參考泳道(通常是第一個(gè)樣品泳道,也可以是人為認(rèn)定的其他泳道),以參考通道的內(nèi)參蛋白信號強(qiáng)度為基準(zhǔn),將其與其他泳道的內(nèi)參有效信號值相除,得出每個(gè)泳道的歸一化因子(normalization factor)。最后,將靶蛋白條帶有效信號值乘以歸一化因子,得到條帶信號強(qiáng)度的歸一化數(shù)值,以此歸一化值作為蛋白表達(dá)豐度統(tǒng)計(jì)分析的依據(jù)。
Western Blot實(shí)驗(yàn)常用內(nèi)參蛋白有兩種。一種是存在于所有樣品中、且其表達(dá)較穩(wěn)定的管家蛋白(Housekeeping protein, HKP)。另一種是印跡中各泳道的總蛋白。無論選誰做內(nèi)參,都需滿足兩個(gè)條件:
1)內(nèi)參的表達(dá)須不受組織來源、實(shí)驗(yàn)處理方法的影響;
2)電轉(zhuǎn)印完成后,靶蛋白、內(nèi)參蛋白的信號強(qiáng)度均應(yīng)處于各自的檢測線性動(dòng)態(tài)范圍內(nèi)(即檢測信號強(qiáng)度隨蛋白質(zhì)上樣量增加而成比例增加)。
不少研究已觀察到:管家蛋白在不同組織來源表達(dá)量不同,經(jīng)不同實(shí)驗(yàn)干預(yù)處理后表達(dá)也不相同。內(nèi)參蛋白通常表達(dá)量較高,但上樣量—條帶信號強(qiáng)度線性關(guān)系表現(xiàn)不佳。而通常靶蛋白的表達(dá)較低,當(dāng)加大靶蛋白上樣量時(shí),高表達(dá)的管家蛋白易出現(xiàn)過載,信號強(qiáng)度超出其定量線性范圍的情形。因此,未經(jīng)驗(yàn)證地將β-肌動(dòng)蛋白(β-actin)、甘油醛3-磷酸脫氫酶(GAPDH)、α-微管蛋白(α-tubulin)和次黃嘌呤磷酸核糖基轉(zhuǎn)移酶1 (HPRT1)等管家蛋白用作Western Blot內(nèi)參,從流程到方法都是錯(cuò)誤的。
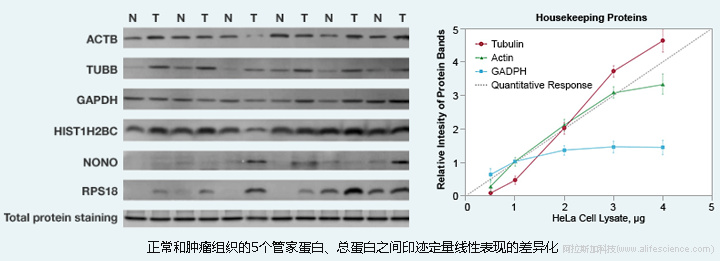
而總蛋白歸一化(Total Protein Normalization, TPN)方法則克服了管家蛋白歸一化方法的諸多缺點(diǎn)。
TPN是指Blot的單個(gè)泳道內(nèi)所有蛋白條帶的總信號值扣除背景后的總有效值確定為該泳道內(nèi)蛋白總上樣量、將此信號值與參考泳道相應(yīng)指標(biāo)來相除結(jié)果作為該泳道所有蛋白條帶信號強(qiáng)度的歸一化因子的方法。
所有條帶總蛋白作為內(nèi)參蛋白,不易受實(shí)驗(yàn)處理方法、組織細(xì)胞來源的影響,而最重要的是,大多數(shù)總蛋白的線性動(dòng)態(tài)范圍能與低表達(dá)靶蛋白的線性范圍匹配。研究表明,在 10–50μg常規(guī)上樣量范圍,總蛋白Blot信號值均表現(xiàn)出良好線性特征,不易出現(xiàn)信號過飽現(xiàn)象,可真實(shí)地反映該泳道的總蛋白上樣量。因此,TPN方法可用于大多數(shù)蛋白Blot條帶的定量分析。
目前,部分學(xué)術(shù)期刊要求嚴(yán)格遵守使用內(nèi)參的標(biāo)準(zhǔn),使用可產(chǎn)生線性動(dòng)態(tài)范圍的成像技術(shù)。而越來越多的研究者在發(fā)文中Western實(shí)驗(yàn)中使用了TPN方法。
二、iBright FL1500 Western熒光成像分析儀適用的TPN技術(shù)方案
電轉(zhuǎn)印結(jié)束后,首先要確認(rèn)全部蛋白質(zhì)被正確轉(zhuǎn)移到膜上,以便及時(shí)發(fā)現(xiàn)印跡中任何空泡和轉(zhuǎn)印不均等異常情形,改進(jìn)存在的問題電泳和電轉(zhuǎn)實(shí)驗(yàn)步驟重新實(shí)驗(yàn)。而對Blot各泳道蛋白條帶的可視化處理,既是Blot驗(yàn)證的需要,同時(shí)也是在為進(jìn)行TPN處理做成像準(zhǔn)備。
驗(yàn)證蛋白Blot的一種常見做法是印跡的麗春紅S (Ponceau S)染色(染色的Blot經(jīng)沖洗后可繼續(xù)執(zhí)行印跡免疫檢測)。染色過程耗時(shí)約20分鐘不算長,但麗春紅S與蛋白質(zhì)結(jié)合持續(xù)時(shí)間短,須迅速完成圖像采集,否則染色條帶逐漸褪色后條帶信號強(qiáng)度降低,使總蛋白的定量失準(zhǔn)。操作時(shí)間限制,這僅是麗春紅S染色法的技術(shù)缺陷而已。
在我們看來,麗春紅S染色法用于蛋白Blot條帶總蛋白定量,方法的選擇上就不妥。它本不應(yīng)該被如此高調(diào)、理所當(dāng)然地用于蛋白Blot的定量分析(注:SDS-PAGE凝膠定量例外)。
PubMed收錄期刊發(fā)文中,采用NIH ImageJ Software(也叫Fiji)進(jìn)行Western Blot圖像分析的文章數(shù)以萬計(jì)。ImageJ使用指南中關(guān)于朗珀-比爾定律在圖像定量分析應(yīng)用的說明,想必知悉詳情的研究人員不在少數(shù)。對于蛋白Blot條帶這類樣品圖像信號值與樣品測試成份含量關(guān)聯(lián)問題,指南指出,不透明樣品用反射光源照明生成的圖像,因樣品表面對光源散射、反射,使得這部分來自光源的信號連同圖像有效信號一同被采集形成分析圖像,其圖像信號強(qiáng)度并不能代表待測樣品有效含量。因此,對于蛋白Blot用反射白光照射生成的染色圖像來定量總蛋白,不符合朗珀-比爾定律,定量結(jié)果準(zhǔn)確性就更值得商榷。
根據(jù)ImageJ指南說明,蛋白Blot這類樣品檢測,應(yīng)該是基于樣品本身發(fā)射的熒光、化學(xué)發(fā)光(生物發(fā)光)信號形成的圖像進(jìn)行定量分析。故采用ECL發(fā)光、熒光染料標(biāo)記所獲取的蛋白Blot圖像作為蛋白定量依據(jù),可謂是恰得其所。
可用于蛋白Blot熒光標(biāo)記染料,如SYPRO Ruby(SYPRO寶石紅)等,不僅相對昂貴,還需固定、隔夜染色和脫色一系列精細(xì)操作處理,其過程耗時(shí)而繁瑣。
反觀伯樂Stain-Free免染凝膠、Invitrogen No-Stain 免染型蛋白染色試劑代表的新型免染成像技術(shù),不僅與下游免疫印跡檢測流程完全兼容,可在短短2分鐘內(nèi)完成蛋白質(zhì)轉(zhuǎn)印效率的驗(yàn)證,而且條帶熒光信號強(qiáng)度不受染色或脫色操作時(shí)間影響,信號穩(wěn)定。這極大加快、簡化Western Blot條帶可視化和總蛋白定量過程。
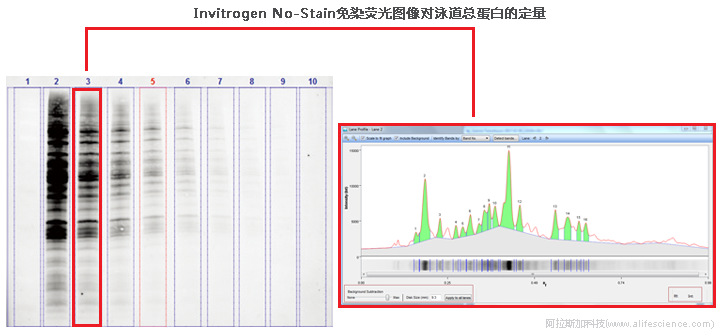
那iBright FL1500系統(tǒng)是否支持所有免染蛋白熒光成像技術(shù)方法?回答是:不全部支持。
伯樂Stain-Free免染膠蛋白熒光成像技術(shù)的核心是在手灌SDS-PAGE凝膠或商品化預(yù)制膠中添加了一種三鹵化合物。該化合物與蛋白質(zhì)分子中的色氨酸殘基共價(jià)結(jié)合,不干擾電泳或轉(zhuǎn)膜實(shí)驗(yàn)。三鹵化合物自身不產(chǎn)生熒光,而它與蛋白質(zhì)共價(jià)復(fù)合物經(jīng)302nm紫外激發(fā)能產(chǎn)生熒光,且熒光信號持續(xù)貫穿于凝膠電泳及轉(zhuǎn)膜全過程,便于成像分析。
而iBright FL1500配置缺少必要的反射式UV激發(fā)光(標(biāo)配LED綠色透射光激發(fā)光源不適用),無法激發(fā)伯樂的Stain-Free免染凝膠完成TPN分析,故只能使用Invitrogen No-Stain免染蛋白染色試劑。
Invitrogen No-Stain蛋白標(biāo)記試劑與蛋白分子的賴氨酸側(cè)鏈部分形成共價(jià)鍵,可在每孔上樣 1–80μg總蛋白的上樣量范圍內(nèi)保持優(yōu)良的檢測線性。該試劑可使用UV、綠色LED(Ex 520 mm)或藍(lán)色LED(Ex 488 mm)光源激發(fā),發(fā)射波長為590 nm。
iBright FL1500同時(shí)配置有LED綠色透射光源(用于透明SDS-PAGE凝膠的激發(fā))、反射式藍(lán)(Epi-LED 455-485nm)、綠(Epi-LED 515-545nm)激發(fā)光(蛋白轉(zhuǎn)印膜的染料激發(fā))和波長范圍568-617nm的熒光發(fā)射濾光片,可完美勝任蛋白凝膠、蛋白印跡的Invitrogen No-Stain蛋白免染熒光標(biāo)記成像和對蛋白Blot的TPN檢測。
三、Western Blot TPN方法應(yīng)用的iBright FL1500熒光檢測通道方案
基于《英捷iBright FL1500 Western熒光成像分析儀技術(shù)特點(diǎn)解析-1》的討論意見,iBright FL1500的Em3、Em4兩個(gè)檢測通道只能二選一。而Western Blot實(shí)驗(yàn)引入Invitrogen No-Stain熒光染料進(jìn)行TPN校正后,為確保各靶蛋白條帶、泳道上總蛋白熒光信號的特異性,TPN需單獨(dú)占用EM2發(fā)射信號通道。
iBright FL1500印跡熒光成像分析儀熒光檢測通道配置
測試光學(xué)通道 | 工作波長 | 檢測應(yīng)用 |
凝膠熒光激發(fā)通道 | Trans-UV 480nm | Invitrogen No-Stain熒光染色凝膠的檢測 |
印跡熒光激發(fā)通道 | ?Epi-LED 455-485nm | Invitrogen No-Stain熒光染料標(biāo)記Blot激發(fā) |
Epi-LED 515-545nm | Alexa Fluor 532、Alexa Fluor 546等染料激發(fā) | |
Epi-LED 608-632nm | Alexa Fluor 633等染料激發(fā) | |
Epi-LED 610-660nm | Alexa Fluor 633、Alexa Fluor 647等染料激發(fā) | |
Epi-LED 745-765nm | Alexa Fluor 750等染料激發(fā) | |
通用熒光檢測通道 | EM1:508-537nm | 綠色熒光標(biāo)記基團(tuán)Blot檢測 |
EM2:568-617nm | Invitrogen No-Stain熒光染料標(biāo)記Blot的TPN檢測 | |
EM3:675-720nm | 紅色熒光基團(tuán)二抗Blot檢測(不能與EM4同時(shí)啟用) | |
Em:4:710-730mn | 近紅外熒光基團(tuán)二抗Blot檢測 | |
Em:5:800-850nm | 遠(yuǎn)紅外熒光基團(tuán)二抗Blot檢測 |
iBright FL1500可供分配給各蛋白條帶熒光信號檢測的通道只有EM 1、EM 3(或Em 4)、Em 5三個(gè)。這正是iBright FL1500系統(tǒng)配置5個(gè)熒光通道,但引入TPN方法后最多只能同時(shí)測3個(gè)靶蛋白的原因。
其中,EM 1綠色熒光通道在檢測基質(zhì)復(fù)雜樣品Blot時(shí),很可能還會受到背景熒光的干擾。為改善檢測信噪比,選擇靶蛋白熒光二抗時(shí),可參考以下經(jīng)驗(yàn)做法:低豐度靶標(biāo),盡量用亮度較亮的短波長熒光基團(tuán)標(biāo)記二抗(如Alexa Fluor 546和Alexa Fluor Plus 647);而高豐度靶標(biāo),則選用波長較長熒光基團(tuán)標(biāo)記抗體(如Alexa Fluor Plus 680和Alexa Fluor Plus 800)。
至于如何在Western Blot實(shí)驗(yàn)中獲取免染熒光標(biāo)記Blot總蛋白圖像,且聽《英捷iBright FL1500 Western熒光成像分析儀技術(shù)特點(diǎn)解析-3》為您分解。
參考文獻(xiàn):
[1]Angela Dittmer, Jürgen Dittmer. β-Actin is not a reliable loading control in Western blot analysis. Electrophoresis. 2006; 27(14):2844–2845.
[2]Robert D Barber, Dan W Harmer, Robert A Coleman, et al. GAPDH as a housekeeping gene: Analysis of GAPDH mRNA expression in a panel of 72 human tissues. Physiol Genomics. 2005;21(3):389-95.
[3]Rena Li, Yong Shen. An old method facing a new challenge: Re-visiting housekeeping proteins as internal reference control for neuroscience research. Life Sci.2013;92(13):747-51.
[4]Xiaowen Hu, Shujiao Du, Jiekai Yu, et al. Common housekeeping proteins are upregulated in colorectal adenocarcinoma and hepatocellular carcinoma, making the total protein a better "housekeeper". Oncotarget. 2016;7(41):66679-66688.
[5]Samantha L Eaton, Sarah L Roche, Maica Llavero Hurtado, et al. Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting. PLoS One. 2013;8(8):e72457.
[6]Roisean E Ferguson, Helen P Carroll, Adrian Harris, et al. Housekeeping proteins: A preliminary studyillustrating some limitations as useful references in protein expressionstudies, Proteomics. 2005;5(2):566-71.
[7]J J Bass, D J Wilkinson, D Rankin, et al. An overview of technical considerations forWestern blotting applications to physiological research. Scand J Med Sci Sports.2017Jan;27(1):4-25.
[8]Rajeshwary Ghosh, Jennifer E Gilda, Aldrin V Gomes. The necessity of and strategies for improving confidence in the accuracy of western blots. Expert Rev Proteomics. 2014 Oct;11(5):549-60.
[9]Samantha Greer, Rice Honeywell, Mulu Geletu, et al. Housekeeping genes; expression levels may change with density of cultured cells. J. Immunol. Methods.2010;355(1-2):76–79.
[10]Georgina M Aldridge, David M Podrebarac, William T Greenough, et al. The use of total protein stains as loading controls: an alternative to high-abundance single-protein controls in semi-quantitative immunoblotting. J Neurosci Methods. 2008;172(2):250-4.
[11]J J Bass, D J Wilkinson, D Rankin, et al.An overview of technical considerations for Western blotting applications to physiological research. Scand J Med Sci Sports. 2017;27(1):4-25.















