產品課堂
如何用MIQE標準指導多重實時熒光定量PCR實驗的流程與驗證設計?-下
應用驅動型qPCR儀選型攻略-8
三、按MIQE要求建立多重實時熒光定量PCR分析法的實例分析
對多重實時熒光定量PCR方法分析性能的評價,MIQE指南設立了qPCR validation一環,實驗者提供必要信息事項便于審核qPCR實驗結果。其中E類(essential information)為必須隨稿件提交的信息,而D類(Desirable information)屬應盡可能提交信息項。
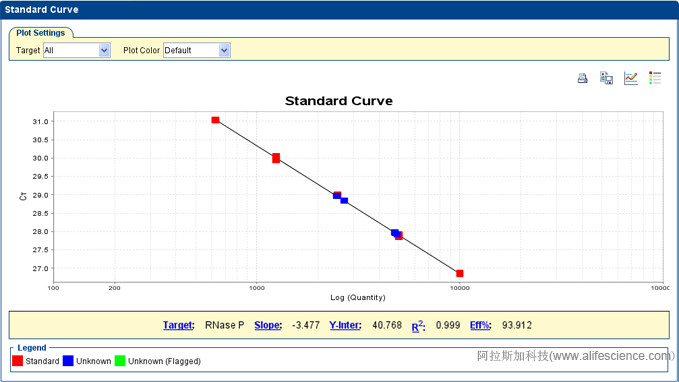
表2 MIQE checklist for qPCR validation
序號 | qPCR實驗信息審查項 | 重要性 | qPCR反應信息項說明 |
1 | Specificity(gel, sequence, melt, or digest) | E | 實時熒光定量PCR法分析特異性指當樣本中有其他非特異性靶標存在情況下,用qPCR法可針對性地檢測到目標序列的能力。凝膠電泳/測序/熔解曲線等均可用于證明qPCR反應特異性。 多重實時熒光PCR反應的特異性還需交叉反應法驗證。用于交叉反應驗證的靶標有: 1)同源性核酸序列,或引起相同或相似癥狀的其他病原體核酸; 2)被檢測基因的其他基因型片段或其他基因型構建的質粒等基因工程產品; 3)高濃度的其他核酸對目標核酸的交叉反應的驗證。 |
2 | Calibration curves with slope and y-intercept | E | 建立實時熒光定量PCR實驗的標準曲線目的在于評估目標片段擴增效率和依據標準曲線方程計算待測樣品中目標片段模板初始含量,同時評估定量檢測有效線性范圍。 內參標準品可用載有靶基因線性化質粒DNA、比目的擴增片段長的純化靶基因PCR產物或基因組DNA、濃縮的cDNA模板。須與靶基因同步擴增和具有相同擴增效率 1)用標準品和建立標準曲線對樣本中靶序列絕對數量測定。 每個靶基因的絕對定量都需建立標準曲線。多重實時熒光定量PCR實驗須為每種靶基因建立一標準曲線。 將含有已知靶序列拷貝數量的標準品,通過連續等比稀釋(如1:2、1:3、1:10倍率稀釋)制備至少5個濃度的標準品稀釋液,每個稀釋度設3個技術重復。標準品的靶基因拷貝數范圍達到5-6個對數量級,足以覆蓋待測樣品的濃度區間,以確保定量準確性。 實時熒光定量PCR儀記錄樣本和標準品各稀釋液的Cq值(每個反應管內的熒光信號到達設定熒光信號閾值時所擴增循環數),并以標準品稀釋液中靶序列拷貝數的對數為x軸,該稀釋度Cq值為y軸,生成標準曲線并給出線性擬合方程y=kx+b。將樣品測試Cq值代入方程計算出樣品的靶基因起始拷貝數。 2)相對定量多重實時熒光PCR實驗,多個靶標可共同一個內參,建立一條內參標準品標準曲線和進行靶標的歸一化處理。 |
3 | r2 of calibration curve | E | 實時熒光定量PCR儀軟件生成標準曲線時自動給出曲線的回歸相關系數R2值。它代表標準曲線回歸線與標準反應的單個Cq數據點之間的擬合程度。R2值越接近1,說明曲線與測出數據吻合程度越高。 通常R2值>0.99被視為測試數據線性關系較理想。 |
4 | PCR efficiency calculated from slope | E | 使用標準曲線中回歸線的斜率k來計算出擴增效率: PCR效率=10 -1/k -1 理論上k=-3.32,實際擴增時k值在-3.59~-3.10(對應于反應效率是90-110%)是較理想的狀態。 |
5 | Linear dynamic range | E | 線性動態范圍/標準曲線的定量范圍 (PCR反應的動態范圍,即平均校準曲線法的從最高到最低定量拷貝數。動態范圍應跨越5-6個1og10濃度范圍或至少達到3個數量級,以覆蓋所檢測目標的定量范圍。 |
6 | Evidence for LOD | E | 單重qPCR的檢測極限(Limit of Detection,LOD) 實時熒光定量PCR方法分析靈敏度可用檢測極限表示。LOD是在特定分析程序在95%概率的下可以準確測定的樣本中待測核酸模板的最低樣本濃度(最小拷貝數)。當濃度在LOD水平處的待測樣本進行多次重復測定,95%的概率可有效測定,而檢測失敗概率小于5%,則該濃度視為置信區間95%條件下的LOD。 標準曲線中b為y軸的截距,代表x軸上最低拷貝數的靶模板產生陽性擴增時的理論Cq值和檢測方法的理論最低檢測限(可能是3拷貝/PCR。假設符合泊松分布,PCR有95%的概率檢測到1個拷貝)。 LOD常表述為單位質量的組織或單位體積的液體中模板的拷貝數(copies/μg或copies/μl)。 |
7 | Cq variation at LOD | E | LOD時的Cq變化 定量下限的界定時,應提供整個線性動態范圍內的CIs值,報告線性范圍內最低濃度處的變異。 |
8 | If multiplex, efficiency and LOD of each assay | E | 多重qPCR反應中每個分析目標的擴增效率和LOD 多重實時熒光定量PCR實驗,多組引物-探針混合情況下,分別為每種測試靶標標準品建立標準曲線,評估在多重反應條件下每種靶標的擴增效率和測試LOD值。 |
9 | For SYBR Green I,Cq of the NTC | E | 陰性對照NTC的Cq(SYBR Green I適用) (在實時熒光定量PCR反應中,應設置無模板對照(NTC)孔,即含有水或緩沖液的反應孔但不含樣本模板的反應孔。陰性對照反應孔中不應發生陽性的擴增信號) |
10 | Evidence of optimization (from gradients) | D | 多重實時熒光定量PCR反應條件最適的證明 常規多重PCR通常須分別進行單重PCR確定各引物和模板用量、退火溫度和擴增循環數等擴增條件。據此進一步優化多重引物混合反應的擴增參數,確立多重PCR體系。特別是各組引物退火溫度不一時,通過梯度溫度實驗來優化體系整體退火參數。 實時熒光PCR反應中,雙溫度循環法的退火-延伸參數固化,因此多重PCR中梯度溫度優化,多重實時熒光定量PCR實驗中不再作硬性要求。 但可提供多重PCR體系反應體積、各引物-探針組用量配比、循環次數和(或)退火溫度優化方法和結果予以說明。 |
11 | CIs for PCR efficiency or SE | D | PCR效率的置信區間(confidence intervals,CIs)或標準誤(standard error,SE) 平均PCR效率的CIs或SE值需對同一批樣品采用相同操作流程和實驗條件進行的多次校準曲線實驗的方法得到,下同)。 |
12 | CIs throughout range | D | 整個檢測范圍的置信區間(CIs) (需對同一批樣品進行多次重復標準曲線實驗確認置信區間95%條件下樣品濃度的檢測范圍) |
我們以德國霍恩海姆大學研究人員發表的《建立一種四重實時熒光定量PCR分析法鑒別大豆感染的真菌病原體D. longicolla,D. caulivora,D. eres和D. novem》為例,梳理多重實時熒光定量PCR分析方法的創建流程,使之符合MIQE指南要求。
3.1 實驗研究背景
大豆莖潰瘍病菌(Diaporthe)為間座殼屬真菌,以菌絲形態寄生于種子、植株和土壤中。植株感染后發生莖桿腐爛而嚴重影響大豆產量,屬各國禁止入境的檢疫性有害生物物種。
全球食用非轉基因大豆需求增長迅猛,加之氣候變暖,中歐大豆種植擴大,加劇大豆莖潰瘍病菌傳播風險。植物病理專家確定D. longicolla(DPCL),D. caulivora(DPCC),D. eres(DPCE)和D. novem(DPCN)四種大豆莖潰瘍病菌為該地區優勢物種,嘗試建立從種子、植株中快速可靠同時檢測這4種病菌方法,用于豆種病原污染評估、篩選及開展大豆田間流行病學監測。
3.2 四重實時熒光定量PCR分析法建立步驟
表3 Step by Step of the establishment for quadruplex real-time PCR assay
Items | Steps | Materials and methods descriptions | Remarks |
| 1 | 多重實時熒光定量PCR目標確立 | 建立可同時鑒別DPCL、DPCC、DPCE和DPCN四種真菌的多重實時熒光定量PCR梵音檢測體系 | |
2 | 引物(和)探針組設計和評估 | 基于TEF基因設計4種菌種特異性引物探針組: 1) sequence alignments:ClustalW as implemented in BioEdit (version 7.1.3.0); 2) Tm and potential secondary structures of primers and probes evaluated with Gene Runner (Version 6.5.52 Beta); 3) specificity of the primers evaluated by NCBI’s Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/); | 1)多重實時熒光PCR的正反向引物、熒光標記探針3個寡核苷酸均須是序列高度特異(如與其他序列結合會降低PCR效率、出現假陽性結果); 2)BLAST軟件序列特異性檢查; 3)4重實時熒光PCR體系需鑒定12個寡核苷酸序列的特異性。 |
4種真菌TEF序列通用正、反向引物設計 (擴增4種病原菌的TEF基因片段) | 擴增產物既作熒光定量PCR引物探針特異性、靈敏度驗證測試靶,又用作單重、多重定量PCR反應標準曲線內參標準品 | ||
大豆看家基因GmUKN2引物設計 (定量樣品中大豆DNA數量) | 大豆DNA作為外參,計算單位質量的豆種中病原菌DNA量,評估真菌感染程度 | ||
| 3-1 | 待測和各種對照品DNA提取 | 4種培養的目標真菌菌絲基因組DNA的分別提取 | PCR產物制作定量內參標準品和實時熒光定量PCR檢測目標 |
其他非目標病原菌DNA的分別提取 | 設立單獨反應孔作對照,評估各引物-探針組的特異性 | ||
健康大豆植株中提取DNA | 作陰性對照設立單獨反應孔,驗證探針的特異性) | ||
人工DPCL菌屬感染的大豆莖稈、種子和種皮中分別提取DNA | 用于實際檢驗四重熒光定量PCR檢測方法的有效性 | ||
3-2 | 4種目標菌種TEF DNA序列PCR擴增 | Diaporthe isolates TEF regions amplifications TEF regions primers EF1-728F (5’-CATCGAGAAGTTCGAGAAGG-3’) and EF1-986R (5’-TACTTGAAGGAACCCTTACC-3’) in individual reactions for the different Diaporthe isolates. 25μl Reaction mixtures: 2.5μl 10x Taq buffer with (NH4)2SO4 (Thermo Fisher Scientific), 2.5μl 2 mM dNTPs, 2.5μl MgCl2 (25 mM), 12.5 pmol of each primer set, 1μl Taq DNA polymerase (1 U/μl), and 1μl genomic DNA. Amplification conditions: 3min - 95℃, 35 cycles (denaturation 30s -95℃, annealing 30s - 68℃, elongation 30s - 72℃), and a final 5min -72℃ elongation. PCR products were checked on 2% agarose gels electrophoresis. PCR products were purified using the PEQGOLD Cycle-Pure Kit (PEQLAB Biotechnologie) and determined by Qubit 2.0 Fluorometer (Thermo Fisher Scientific). PCR products containing 109 to 104 copies/μl, diluted with DNA prepared from soybean tissue, roughly 20ng, 2ng, 200pg, 20pg, 2pg, 0.2pg, and 0.02pg DNA per reaction. | 1)本例內參標準品用的是各目標菌屬的TEF基因擴增片段; 2)文中實驗結果中的標準品起始濃度范圍為20ng – 0.02pg共7個數量級;實際配制了覆蓋10-1010 copies共10個數量級的標準品。 |
3-3 | 4種目標真菌基因組DNA樣品制備測定 | genomic DNA of the Diaporthe isolates was both determined by measuring absorption at 260nm and by Qubit 2.0. 1:10–1:106 dilution series were prepared with 50 μg/ml DNA prepared from healthy soybean tissue. | 1)各目標菌種DNA提取樣品用健康大豆DNA稀釋液稀釋成1/10、1/100、1/1000三個濃度梯度(模擬真實檢測樣品基質條件測試),以降低DNA樣品中PCR抑制成分干擾,確認實測條件。 2)目標菌株DNA樣品用于評估多重實時熒光定量PCR體系引物-探針組的特異性。 |
4-1 | Assessing the specificity of the primer-probe sets | singleplex real-time PCR assays amplification efficiency Assessing: using serial dilutions of PCR products(10 to 109 copies) for amplification standard curves; Assessing conditions of the test for Diaporthe infestations, 1:1,1:10,1:100,1:1000 serial dilutions of genomic DNAs from the different Diaporthe isolates were also used for quantification standard curves; non-target Diaporthe species No-template controls were included 20μl Reaction mixtures:10μl ready to use SensiFAST Probe No-ROX mix (2x) (Bioline GmbH),8 pmol of each forward and reverse primers,2 pmol probe,2μl template DNA; Amplification conditions: 3 min at 95℃ and 40 cycles of 95℃ - 15s and 60℃ - 45s; CFX96 Real-Time PCR system (Bio-Rad) FrameStar 96-Well Skirted PCR Plates (4titude, USA) | DPCL、DPCC、DPCE和DPCN四引物-探針組擴增效率、特異性單重實時熒光定量反應驗證 1)分別用四種菌株DNA、非目標菌株DNA及空白對照,逐一測試每各引物-探針組特異性; 2)以四TEF基因PCR產物作標準品分別建立單重熒光定量標準曲線,檢驗在避免PCR抑制干擾理想情況下單重反應的擴增效率和檢測限; 3)用4種菌株DNA提取液的1:1、1:10、1:100、1:1000稀釋液為內參標準品構建標準曲線,評價實測條件下的擴增效率和條件; |
4-2 | Assessing the specificity of the primer-probe sets | Duplex real-time PCR assays with primer-probe combinations (consists of 4 in individual reactions: parallel dilution series of both species,and one undiluted (20ng) genomic DNA combined with 1:1000 diluted genomic DNA of the other species) DPCL+DPCC DPCL+DPCE DPCL+DPCN DPCC+DPCE DPCC+DPCN DPCE+DPCN Reaction mixtures:10μl 2x SensiFAST Probe No-ROX mix, and a reduced amount of 4pmol of each primers set, 1 pmol of each of the two probes, and 2μl template DNA. Amplification conditions: as Duplex | 引物探針組特異性的交叉檢驗:將4個引物探針組兩兩配對(6種組合)進行雙重熒光PCR實驗。 1)對平行稀釋DNA混合測試:分別對兩種病原菌的未稀釋(20ng)的DNA混合物、兩種1/1000稀釋DNA混合物檢測; 2)對兩種不同稀釋度真菌DNA(一種1:1而另一種1/1000稀釋)的混合測試,檢驗當一種模板濃度遠高于另一個模板濃度情況下競爭抑制和多重反應有效性。如對DPCL+DPCC組合的測試分為: ①未稀釋DPCL+稀釋DPCC DNA混合; ②稀釋DPCL+未稀釋DPCC DNA混合; |
4-3 | Specificity of the quadruplex real-time PCR assay | 1)4種引物-探針組組合同時對2種真菌檢測 DPCL + DPCC;DPCL + DPCE;DPCL + DPCN;DPCC + DPCE;DPCC + DPCN;DPCE + DPCN 2)4種引物-探針組組合同時對檢測3種真菌檢測 DPCL + DPCC + DPCE;DPCL + DPCC + DPCN;DPCL + DPCE + DPCN;DPCC + DPCE + DPCN 3)4種引物-探針組組合同時對4種真菌檢測 DPCL + DPCC + DPCE + DPCN 4)4種引物-探針組組合對其他大豆病原菌種檢測 Reaction mixtures:as Duplex Amplification conditions: as singleplex. | 四重實時熒光定量PCR檢測體系特異性檢驗 1)4個引物探針組混合,測試2種、3種靶DNA共存時的特異性。 2)4個引物探針組能同時檢測四種靶DNA的特異性。 3)所有情況下,各引物探針組均專一性擴增靶DNA。非目標菌體、健康大豆葉和莖的DNA測試均無擴增。 |
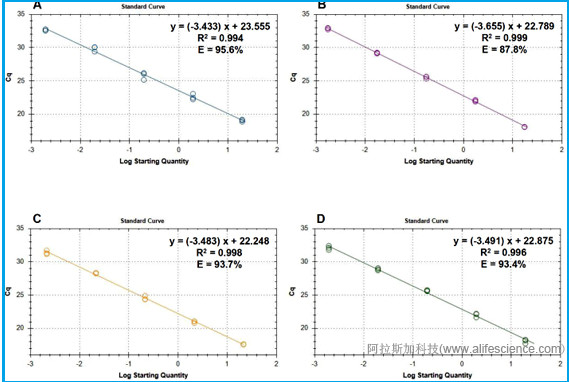
4-4 | 多重熒光定量PCR反應體系標準曲線的建立 | Standard curves establishing for the quadruplex real-time PCR assay DNA isolates from 4 target Diaporthe species were diluted with DNA prepared from soybean tissue, roughly 20ng, 2ng, 200pg, 20pg, 2pg, 0.2pg, and 0.02pg DNA per reaction; The standard curves used to calculate the amount of Diaporthe DNA in ng per reaction; a rough estimate of the limit of detection (LOD) and a Cq cut-off values. | 分別取4種菌株DNA,用健康大豆DNA連續稀釋制備的內參標準品進行標準品標準曲線實驗。 分別建立4個靶基因標準曲線; 確定各靶標檢測的LOD(和Cq的cut-off值) |
5 | 多重熒光定量PCR反應方法的實測驗證 | Validation of the quadruplex real-time PCR assay 1)Infected soybean stems detect DNA from Diaporthe spp. prepared from stem samples covered with pycnidia. D. longicolla DNA was detected in all tested samples with visible symptoms. For healthy stem samples the primer-probe sets produced no amplification. 2)Screening soybean seeds All four Diaporthe species could be detected in different seed samples known to contain seeds infected with Diaporthe strains. For healthy seeds no amplification. | 用實際感染目標真菌的大豆植株樣品和大豆種子和健康大豆種對照,檢驗多重實時熒光定量PCR檢測體系有效性。 |
6 | Reaction mixtures for quantifying soybean DNA | Reaction mixtures:10μl 2x SensiFAST SYBR No-ROX mix, 8 pmol each of primers GmUKN2f and GmUKN2r, and 2μl template DNA. as Duplex Amplification conditions: as singleplex. No-template controls were included | 用大豆GmUKN2基因作為外參,計算單位大豆中真菌基因含量,評估感染風險和鑒定豆種品質。 |
對照表3、4可以看出:MIQE指南中qPCR驗證1-10個E類項,文中都悉數提供。D類項目的多重反應體系優化細節(如多重PCR引物-探針組組分間配比優化過程、循環次數優化、最終反應體積的優化和退火延伸溫度選擇等)、標準曲線實驗的多次重復確認LOD依據、LOD檢測限置信區間和LOD對應的Cq值SD均未見補充說明。此外,關于實驗方法的Repeatability(E類)和Reproducibility(D類),文中也未提供說明。
相對而言,多重實時熒光定量PCR檢測方法建立全流程,從單重反應到多重反應的建立、反應特異性驗證及擴增效率評估方面,資料詳實。
文中引入了多組引物-探針并存、高濃度非靶標競爭條件洗的檢測特異性評估實驗,在同類應用文獻中少見,符合MIQE指南要求,尤其值得借鑒。
四、討論
4. 1多重實時熒光定量PCR反應“重”數的問題
多重PCR反應是指在單個反應孔/管內用數組特異性引物同時擴增數個靶序列。“重”是指同一孔內被同時擴增的特異性序列的種數。單管內模板達到兩種(雙重PCR反應)即被視為多重反應。
多重PCR可以通過優化反應體系和反應條件提高擴增的片段種屬。 理論上,只要PCR擴增條件合適,重PCR實驗的模板重數可以不受限制。文獻表明,受限于反應體系優化難度,常規科研實驗以2-9重模板的反應多見。但多重PCR與毛細管電泳平臺(如Beckman GenomeLab GeXP多基因遺傳分析系統,Agilent 2100 Bioanalyzer等)結合,一次反應可對魚類細胞生長調控、脂質代謝、糖皮質激素介導的信號通路、氧化應激和炎癥等生理反應22個關鍵基因和3個對照基因的表達同時分析。而NGS測序的文庫構建中,同步擴增模板可達數千重且上不封頂(high-multiplex PCR或ultrahigh-multiplex PCR和超多重PCR的提法純屬噱頭,PubMed可查論文使用其概念者屈指可數)。
然而,多重實時熒光PCR反應中模板重數擴展則力不從心。
在多重實時熒光PCR反應中,每種擴增片段用正反向引物對+熒光標記探針組合標記,以便有效區分同一反應孔內的不同種靶序列的擴增信號。一色熒光占用一個檢測通道。實時熒光定量PCR儀可同時使用熒光通道配置決定了單孔內可同時檢測的靶序列“重”數。需指出,各品牌實時熒光定量PCR儀標稱的檢測通道數,并非完全等同于可同時檢測的熒光顏色種數(見《實時熒光定量PCR儀熒光檢測通道數量的內涵淺析》)。目前QuantiStudio 5、QuantiStudio 7 Pro、QuantiStudio 7 Flex和ViiA7等平臺,基于熒光探針法的多重實時熒光PCR反應檢測極限是6重。
將TOCE技術、多重PCR反應和HRM分析結合建立的Anyplex II RV16多重熒光PCR檢測套裝,突破6重限制,在單管中同時檢測8種病毒基因。
無論熒光探針或HRM多重熒光定量PCR分析,對“重”的定義是一致的,即:須是在同一個反應孔(而非分散于多個孔)內同時擴增的靶標種數。
4.2 多重實時熒光定量PCR反應多少重為宜?
多重熒光定量PCR分析中,引物和探針設計特異性和有效性(不同靶點引物-探針要確保序列特異性,還需使引物Tm值差異可控以確保所有引物在同一個溫度下退火延伸)、反應組份優化程度(各擴增片段數量、擴增效率不同,間存在抑制競爭效應。豐度高靶點擴增的先發數量優勢,過多消耗dNTP和TaqDNA酶,會抑制較低豐度靶點擴增)是擴增效率的主要限制因素。
此外,特異性驗證流程有BLAST序列特異性檢查、單重反應驗證、多重交叉驗證、高濃度競爭抑制驗證等4個環節。分析靶標種數增多,引物和探針設計難度加大,兩兩組合交叉驗證工作量隨之劇增。
相對而言,3重實時定量反應,驗證環節實驗量較4重反應減少1/3。就效費比,3重定量PCR方法要優于4重反應。
設計5-6重實時熒光PCR實驗,首先是設計和性能驗證更復雜繁瑣。其次,實時熒光定量PCR儀所配檢測通道要能支持6色熒光同時檢測。因部分機型檢測通道的信號采集時間不同步,首末兩個通道檢測的靶標在信號采集時退火-延伸反應時間不對稱。靶標種數越多,2個通道信號采集點時差越長,不同通道對應靶標退火進程有別,必會影響靶標數據檢測準確性和信號強弱對比(見《實時熒光定量PCR儀檢測通道數量擴充的革命來啦?》)。
因此科研應用中,多重實時熒光定量PCR反應的模板重數應量力而行。
4.3 多重實時熒光定量PCR實驗規范化問題
在引物和探針商業化定制服務便利化、實時熒光PCR反應95℃-60℃雙溫度循環擴增盛行的背景下,實施多重實時熒光定量PCR,依然面臨反應體系組分配比優化(可參考《Multiplex polymerase chain reaction: a practical approach》、《Multiplex PCR: critical parameters and step-by-step protocol》等經典文獻)和多重實時熒光檢測方法驗證的難點。
臨床診斷、檢驗檢疫和生物醫學科研實驗,對定量PCR方法的準確性、敏感性、特異性、線性范圍CIs、LOD/LOB/LOQ、Cq的CV值等分析性能要素不盡相同。因此,MIQE指南把退火溫度優化、PCR效率及線性檢測范圍置信區間信息項列為D級,不作強制要求。
調研表明,越是在高分期刊的發文,在按MIQE指南要求設計和驗證多重實時定量反應方法方面疏忽的現象越嚴重。特別是多重實時熒光反應多引物-探針組、多模板并存情況下反應特異性的交叉驗證欠缺普遍。當不同模板濃度相差懸殊條件下是否存在PCR競爭抑制的問題,幾乎被大多數實驗者忽視。
此外,驗證多重實時PCR反應方法的可重復性、結果再現能力、PCR效率和LOD線性區間等問題,業內尚未達成一致。
參考文獻
[1]J S Chamberlain, R A Gibbs, J E Ranier, et al. Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification. Nucleic Acids Res. 1988; 16(23): 11141–11156.
[2]M C Edwards, R A Gibbs. Multiplex PCR: advantages, development, and applications. PCR Methods Appl. 1994;3(4):S65-75.
[3]P Markoulatos, N Siafakas, M Moncany. Multiplex polymerase chain reaction: a practical approach. J Clin Lab Anal. 2002;16(1):47-51.
[4]O Henegariu, N A Heerema, S R Dlouhy, et al. Multiplex PCR: critical parameters and step-by-step protocol. Biotechniques. 1997;23(3):504-11.
[5]Stephen A Bustin, Vladimir Benes, Jeremy A Garson,et al. The MIQE Guidelines:Minimum Information for Publication of Quantitative Real-Time PCR Experiments. Clin Chem. 2009;55(4):611-22.
[6]Sonal Sharma, Neeta Shrivastava. Internal transcribed spacer guided multiplex PCR for species identification of Convolvulus prostratus and Evolvulus alsinoides. Acta Pharm Sin B. 2016; 6(3): 253–258.
[7]Pengcheng Liu, Lijuan Lu, Menghua Xu, et al. A novel multiplex PCR for virus detection by melting curve analysis.J Virol Methods. 2018; 262: 56–60.
[8]Chi Hyun Cho, Bayarjavkhlan Chulten, Chang Kyu Lee, et al. Evaluation of a novel real-time RT-PCR using TOCE technology compared with culture and Seeplex RV15 for simultaneous detection of respiratory viruses. J Clin Virol. 2013;57(4):338-42.
[9]Albert Caballero-Solares, Xi Xue, Beth M. Cleveland, et al. Diet-Induced Physiological Responses in the Liver of Atlantic Salmon (Salmo salar) Inferred Using Multiplex PCR Platforms. Mar Biotechnol (NY). 2020; 22(4): 511–525.
[10]Behnoush Hosseini, Ralf T Voegele, Tobias I Link. Establishment of a quadruplex real-time PCR assay to distinguish the fungal pathogens Diaporthe longicolla, D. caulivora, D. eres, and D. novem on soybean. PLoS One. 2021;16(9):e0257225.
[11]實時熒光定量PCR手冊















