產品課堂
擴增條件再優化在實時熒光定量PCR實驗中的意義和有效途徑-下
應用驅動型qPCR儀選型攻略-2
二、在等溫循環模塊qPCR儀上優化PCR反應的有效途徑
eppendorf、MJ Research和伯樂等是梯度溫度qPCR儀路上的先行者。ABI是在2007年VeriFlex模塊投產后才步入梯度時代,StepOne和StepOnePlus是其標志。在梯度溫度模塊大規模應用前,科學家們手里的普通終點式PCR儀和實時熒光定量PCR儀,都配的是等溫循環模塊。
死了張屠戶,要吃渾毛豬。沒有梯度溫控模塊,科學家們并非在復雜模板擴增時束手無策,或為摸索有效退火溫度就只能進行N輪擴增實驗。
實際上,早在1991年,一套行之有效的PCR優化方法-降落PCR技術(touchdown PCR,TD-PCR)就誕生了。TD-PCR技術是與常規緩沖液組份濃度、循環條件和在梯度模塊上改變退火溫度等常規優化策略完全不同的提高PCR反應特異性的方法。
其工作原理是:在PCR初始階段,退火溫度高于估計Tm值,此時擴增效率低但可避免非特異性PCR產物產生。隨著循環進行,退火溫度遞減,當“降落”至引物-模板結合最佳溫度時(通常比Tm低3-5℃),特異性擴增開始。隨后退火溫度進一步降低,特異性擴增與非特異擴增齊飛。但憑借先發優勢,經過2個循環擴增,特異性擴增產物已實現絕對的數量優勢,對任何其后出現的非特異擴增產生強烈競爭抑制而處于單一主導地位,確保了在剩余進程PCR擴增特異性和擴增效率。
經典TD-PCR程序編輯方法是:從高于引物-模板退火溫度熔解溫度(Tm)值開始,到退火溫度低于Tm值若干為止的范圍,按每個步驟重復2次、相鄰的2X步驟退火溫度依次比上一個2X步驟遞減1-2℃,直到退火溫度設定底限為止的方法,設置熱循環程序前面2N個連續循環步驟。從2N+1開始的剩余循環統一按第2N步驟參數執行。
以2010年J Nucleic Acids刊文中的TD PCR程序為例:
Stage 1:95℃預變性30s;
Stage 2:95℃變性30s→56℃退火30s→72℃延伸1min
Stage 3:每個循環退火溫度降低2℃,從56℃降落到46℃共5個循環;
Stage 4:95℃變性30s,44℃退火30s,72℃延伸1min,完成余下29個循環
Stage 5:72℃延伸10mn;
總計35個循環。
TD-PCR在配置等溫熱循環模塊的普通PCR儀和實時熒光定量PCR儀上就可以實施。同一批常規樣品、同一臺機器同一個運行程序,只需一次運行即可完成特異性擴增。
TD-PCR方法作為基本功能,很早就被融入主流廠商PCR、qPCR儀的程序編程環節。如Agilent SureCycler 8800 PCR儀,設有專門Touchdown PCR設置選項。只是不同機型TD-PCR編程操作界面及簡易程度有別。
目前,Applied Biosystems旗下的qPCR儀,無論是否配置梯度溫度模塊,都采用了AutoDelta選項專用于Touchdown PCR編程設置。如QuantStudio 6 Pro/6 Flex、QuantStudio 7 Pro/7 Flex實時熒光定量PCR儀,在退火步驟編程界面設有Enable AutoDelta選型(圖中藍色箭頭所示)。
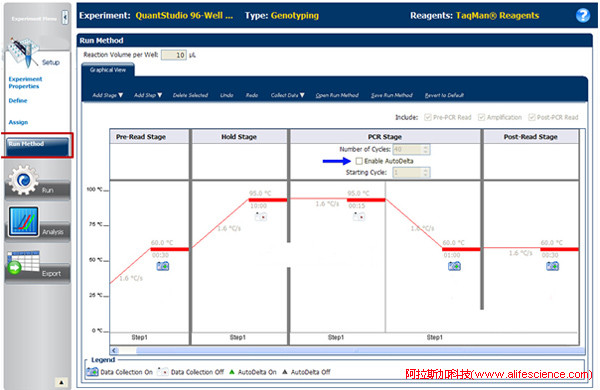
激活選項后會彈出AutoDelta設定界面。指定TD步驟起點、TD溫度降幅和時間遞變幅度、每個溫度重復次數即可,程序設定操作簡便。
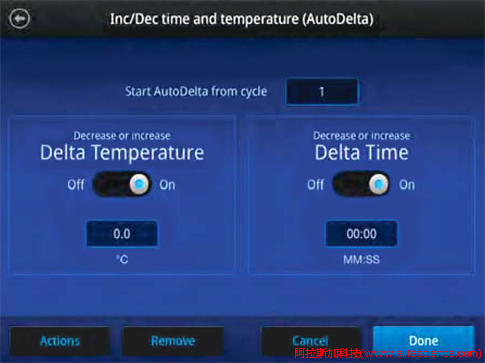
伯樂CFX Opus 96、CFX Duet、CFX 96 touch等qPCR儀在觸摸屏、PC操作端的編程界面中都有GOTO功能,可用作TD程序設定。

點擊Insert選項,選擇在圖中95℃-10sec位置依次用Insert Step命令插入退火參數、延伸步驟參數、讀板,以GOTO命令設置重復步驟起點、循環次數完成第一個TD設置。此后在第一TD步驟之后依次插入第二步TD變性、退火、延伸、讀板和GOTO步驟完成第二個TD設置,以此類推完成整個TD程序設置。
TD-PCR特殊的特異性擴增優勢,可在非特異性背景極高情況下特異性的PCR表現及擴增物的穩產高產。特別適用于常規PCR循環程序難以克隆的復雜基因組DNA模板的擴增,在同時使用幾種非特異性引物情況下還成功地從基因組DNA中擴增出目的擴增子,證明TD-PCR超凡的抗干擾能力。國內外將TD-PCR應用于STR標記遺傳鑒定、基因多態性分布、啟動子的克隆及表達研究、多重降落PCR檢測的案例多至難以枚舉。有人還將采用TD-PCR方法的qPCR實驗命名為TD-qPCR。
三、實時熒光定量PCR實驗反應條件再優化的必要性
MQIE指南規定qPCR實驗應標明完整反應條件、qPCR品牌型號信息及熱循環詳細參數。而實驗的外部環境(如地理位置、海拔高度、氣候條件、實驗環境)和內部條件(如qPCR儀型號和模塊配置、反應體系組成和體積等)都制約PCR熱循環模塊的溫控實效表現。而qPCR儀擴增模塊變溫特征不同會影響實驗結果的一致性。現實條件下的兩個獨立實驗中,要使儀器溫控性能狀態一致、實驗結果精準重現,難度超乎想象。
將普通PCR反應擴增參數跨平臺植入到實時熒光定量PCR實驗中運行,是前提條件的,即普通PCR儀熱循環模塊和qPCR配置反應模塊同款。如將C1000 Touch 96-Well Fast PCR儀的參數嵌入CFX96 Touch qPCR儀可以考慮,因為后者擴增模塊正是C1000 Touch 96-Well Fast模塊。但若將Mastercycler pro梯度模式下所得參數嵌入7500、QuantStudio 1或QuantStudio 6 Flex的運行程序,因彼此間控溫特性截然不同,此方法固不可取。
qPCR實驗不僅包含普通PCR反應全部要素,還疊加了熒光檢測條件和性能差異。何況,同一個模板添加SYBR Green l熒光染料、Taqman探針、FRET雜交探針后的qPCR反應與常規普通PCR反應,最適退火溫度是否發生變化,缺少足夠硬核支持證據,尚無定論。因此,qPCR實驗參考前人條件基礎上,關鍵還是基于實際qPCR儀性能進行必要的條件驗證優化,這本是qPCR實驗內在規律的必然要求。
實時熒光定量PCR儀,無論是配置梯度溫度功能模塊的StepOnePlus、QuantStudio 3、QuantStudio5、QuantStudio 6 Pro、QuantStudio 7 Pro等,以及伯樂的CFX Duet、CFX Opus 96/Opus 384、CFX96/CFX384 Touch,還是采用等溫反應模塊機型QuantStudio 1、QuantStudio 6 Flex、QuantStudio 7 Flex、7500 Fast,在軟件編程環節,都兼顧了常規引物退火溫度梯度編程和TD-PCR程序編輯功能。不僅可自由設定反應步驟、每步溫度、保持時間、是否采集熒光信號等基本參數,還提供了梯度退火溫度、AutoDelta(GOTO重復循環)等高級編輯功能選項,便于量身創建高效可靠的qPCR實驗運行程序。
四、qPCR反應條件再優化需求對實時熒光定量PCR儀選型的指導意義
梯度溫度控制和Touchdown降落PCR是PCR擴增條件優化工作中的常用技術手段。
TD-PCR特異性高,善于應對復雜反應體系、模板的擴增。模塊溫控均一性好,則擴增過程中樣品變溫步調一致,無需糾結于退火溫度的準確值。實驗者根據引物序列條件制定退火溫度的上、下限范圍(以40℃-65℃常見)后,據溫度遞減幅度(1℃-3℃居多)確定具體Touchdown臺階數量和每個降落臺階重復次數(1X-3X為主)。在目前多數PCR儀、qPCR系統上都可以實現,操作簡便,可重復性好。編程界面直觀簡便程度因品牌機型而異。從調研結果看,QuantStudio系列機型TD編程要更簡便。
梯度溫度優化技術,有其固有局限性,“算法模擬”退火溫度和實際溫度游離,始終處于模糊狀態,適度縮窄退火范圍,縮小算法溫度梯度落差,可提高梯度溫度示值的可信性。雖是后起之秀,但編程設置實現傻瓜化。廠商以此為賣點競相宣揚,熱捧之下很快成了家喻戶曉的流量明星,風頭蓋過TD-PCR。所謂新人勝舊人,發展到言PCR必稱溫度梯度的地步。但技術本身的顏值,春華秋實,如此而已。
關于qPCR實驗條件再優化必要性和有效途徑的探討,對制定實時熒光定量PCR儀選型方略的啟示在于:
首先,在PCR編程智能化背景下,TD運行程序設置已極大簡化。選型時應視野開闊、兼容并蓄、博采眾長,不能完全為實驗習慣和唯梯度論所囿。
其次,因地制宜,基于實驗室PCR條件資源,多考慮如何創造有利條件,實現運行參數在普通PCR儀和實時熒光定量PCR儀間的跨平臺有效銜接。
譬如,就現有伯樂C1000 touch 96-well Fast考慮與CFX-96 touch qPCR的對接,而Veriti Pro 96-Well (96×0.2ml,6.5℃/s)可以嘗試與QuantStudio 3、QuantStudio 5、QuantStudio 6 Pro/6 Flex、QuantStudio 7 Pro/7 Flex等幾款配置有96×0.2ml、6.5℃/s規格veriFlex模塊的定量PCR配套使用。舊Veriti (96×0.1ml,5.0℃/s) 擴增儀與StepOne Plus (96×0.1ml,6.5℃/s),雖然都采用的是96×0.1ml的veriFlex模塊,但最大升溫速度(5.0℃/秒VS 6.5℃/秒)和平均變溫速度(4.25℃/秒VS 2.2℃/秒)存在明顯差異,運行參數銜接后擴增效果可能難以做到盡如人意。
從目前看,行業頭部廠商顯然已意識到新上市產品的PCR模塊間的有效兼容,對于實驗運行協議跨平臺轉移的重要性。這似乎代表著實時熒光定量PCR儀的一個發展趨勢。
參考文獻
[1] VeriFlex熱循環溫度控制技術(Applied Biosystems)
[2] Don RH, Cox PT, Wainwright BJ, et al. 'Touchdown' PCR to circumvent spurious priming during gene amplification.Nucleic Acids Res. 1991;19(14):4008.
[3] Hecker KH, Roux KH. High and low annealing temperatures increase both specificity and yield in TD and SD PCR. BioTechniques. 1996; 20(3):478–485.
[4] Tian-Yun Wang,Li Guo, Jun-he Zhang. Preparation of DNA Ladder Based on Multiplex PCR Technique. J Nucleic Acids. 2010; 2010: 421803.
[5] CFX Maestro Software User Guide Version 2.0
[6] Agilent SureCycler 8800安裝和用戶指南C2版(2015年10月)















