產品課堂
擴增條件再優化在實時熒光定量PCR實驗中的意義和有效途徑-上
應用驅動型qPCR儀選型攻略-2
采用SYBR Green I染料的實時熒光定量PCR實驗,須通過熔解曲線分析鑒別引物二聚體或非特異性擴增產物。然而RNA和基因組DNA具有高度遺傳多態性,非特異同源物不僅對靶片段擴增產生競爭抑制,當特異和非特異性擴增產物的Tm值接近時,解離曲線單峰形狀還難以有效區分。此外,qPCR實驗經常出現擴增曲線的基線期過長、指數增長期出現晚且曲線低平、Ct值偏大現象,一般視為擴增效率過低的表現。
qPCR實驗擴增效率和特異性問題,在排除引物設計不當、模板片段過長或數量過少、樣品中存在酶活性抑制、同源物競爭抑制等反應組份的因素后,常嘗試用恢復變性-退火-延伸三步法擴增程序、調整優化退火溫度的辦法來解決。
對于普通PCR實驗優化引物退火溫度實屬老生常談。有人認為,在梯度PCR儀上摸出最佳退火條件后,將參數直接嵌入qPCR儀運行程序就行了,無需作條件再優化的無用功。這種觀點不全對,因其成立是有嚴格條件限制的,對多數實驗環境并不適用。我們來就實時熒光定量PCR實驗反應條件優化的議題展開討論,以圖澄清一些似是而非的觀點,并從中領略對qPCR實驗和選型的有益啟示。
一、傳統PCR熱循環模塊梯度溫控原理與局限性
梯度PCR通常指在引物退火溫度不明確、擴增效果不理想的情況下,借助于PCR儀內置算法在一定溫度范圍內,從高到低依次生成一系列差異化溫度,作為模塊中不同位置各組樣品退火溫度,進行同步擴增,最后根據擴增特異性、擴增產物含量優選出引物最適退火溫度,用做正式擴增參數。
自eppendorf首開PCR儀溫度梯度控制技術先河,引物退火溫度優化與模塊梯度溫功能就被緊密關聯起來。而均一金屬模塊實現梯次差別化溫控的原理,業內長期諱莫如深。
2017年,一份Applied Biosystems發布的測評文件揭開傳統溫度梯度控制的技術原理。
文件有3個要點:
1.1 PCR梯度溫度模塊結構決定了其固有缺陷
PCR模塊溫度梯度控制單元的構造,通常是樣品模塊底部兩端分設1個單獨加熱/冷卻元件。均勻一體的金屬模塊只能有效控制兩端設定的高、低兩個起止點的溫度,而模塊中間大部區域的溫度,完全受熱力學傳導規律支配,是模塊兩端高低溫區相互作用自然形成的,無法實施有效控制。
1.2梯度溫度值是理論預測值而非真實退火溫度
除Bioer GeneMax PCR儀、Agilent 等少數機型,大部分常見PCR金屬模塊上溫度間梯度落差不均勻,溫度值落差曲線呈中間高兩頭低的峰型。
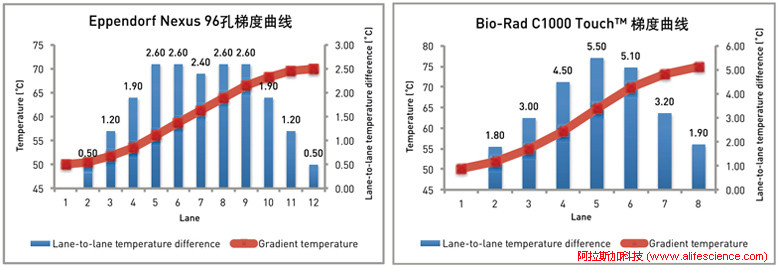
資料顯示,伯樂T100、S1000、C1000-touch是以行的形式生成8個梯度,而eppendorf Mastercycler nexus則按列的方式從左到右依次形成12個梯度溫度。
將技術資料示例圖中的溫度值轉換成梯度序號-梯度溫度散點圖后,結果顯示,梯度溫度分布曲線確實為兩端平緩、中間近似線性走勢的形狀,與qPCR實驗中低效擴增曲線神似。
在梯度PCR反應參數設定環節,將梯度范圍的高低兩端溫度值輸入后,系統立即顯示出不同樣品區域溫度值。說明,這一系列數值只是計算理論模型的預測值。
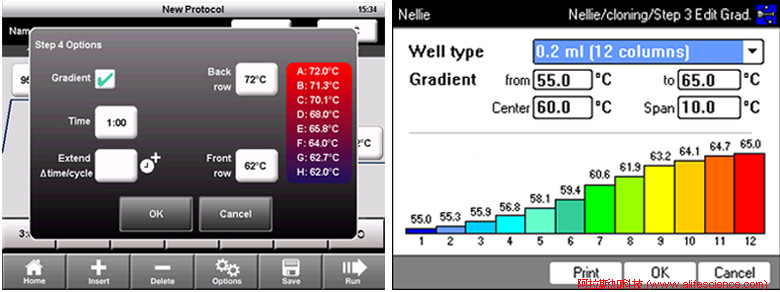
1.3 由算法模型生成的區域梯度溫度與實測值均存在不同程度偏差。
T100 PCR儀偏差+0.6℃ @50℃,Mastercycler Nexus PCR儀偏離–0.4℃ @61.8℃。
當今PCR儀熱循環模塊35℃~99.9℃范圍控溫精度已達到±0.2-0.25℃,而測評中樣品實際退火溫度與梯度模型理論計算值的偏離程度達到0.4℃-0.6℃,已遠超系統正常溫控誤差范圍。表明,系統梯度算法模型生成梯度溫度是不受控制的,并非樣品所處的真實溫度。
以圖中第6列59.4℃與第7列60.6℃為例,綜合考慮算法誤差0.4℃、模塊控溫誤差0.2℃后,59.4℃與60.6℃兩列樣品實際溫度很可能是重疊的。
因此,儀器梯度溫度示值,只能視作特定實驗條件下接近于引物實際退火溫度的理論值之一,而非確定值。不同品牌儀器梯度模型算法的不同,計算誤差有別。故換臺機器進行同一個樣品梯度實驗,最佳退火溫度的示值很可能會發生偏移。
將特定條件下梯度示值認定該引物最適退火溫度推而廣之,跨平臺照搬重復實驗,在理論上確有刻舟求劍之虞。
實際上,除了平臺間引物退火溫度算法誤差造成溫度界定模糊,正如《PCR升降溫速度在實時熒光定量PCR實驗中的作用與意義-下》所論,不同PCR模塊變溫速度特性不一,同樣對對跨平臺移植PCR運行程序的實驗結果產生干擾。
關于PCR變溫速率控制技術優劣問題,業內意見分為兩派,一派是ABI、伯樂等代表的“動態變溫速率”派,另一派是eppendorf代表的恒速變溫派。
1)恒速變溫派認為,PCR熱循環模塊在變形-退火-延伸循環的變溫曲線斜率應該保持恒定(即SteadySlope),這樣確保采用SteadySlope技術的平臺間可以相互復制運行協議,機器運行狀態保持一致,無需重新優化退火條件便可確保擴增的完美重復。相反,若其中一臺機器缺乏SteadySlope控制,即便運行相同protocol,也因變溫速率特性不同,造成運行狀態的差異和實驗結果不一致。
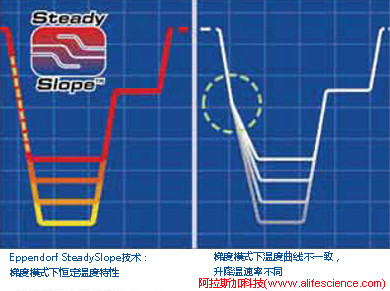
2)動態變溫派則認為,動態變溫曲線控制技術優點顯而易見:確保運行相同協議時,模塊溫度轉換進程的相同時間內同步抵達不同梯度溫度而非梯次到達,確保各梯度溫度的維持時間保持一致。而恒速變溫由于所有梯度進程的變溫速率相同,造成溫度跳轉“里程”差,不同樣品在退火溫度環節保持時間出現差異:梯度值高的樣品退火溫度保持時間最長,梯度值低的樣品保持時間最短。梯度溫度保持時間的差異,必然影響各組的擴增效果,從而影響優選溫度的可靠性。
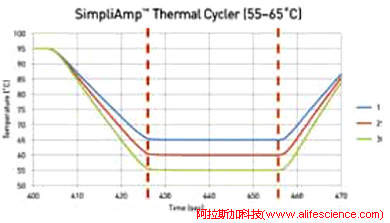
其實,無論是SteadySlope技術,還是動態變溫技術,想讓PCR運行協議跨平臺移植共享都是有前提的,即不同平臺循環模塊升降溫特征的基本一致。如QuantStudio 3、QuantStudio 5實時熒光定量PCR儀均配置了通用96×0.1mL快速反應模塊, 二者間多數qPCR協議就可以相互傳遞直接運行。但若該協議植入StepOnePlus或CFX Duet、CFX Opus 96/CFX96-Touch中運行,要取得一致實驗結果,則絕非易事。
為適應PCR運行程序跨平臺應用需求,廠商開發了熱力學模擬功能模式 (Simulation Mode),即A機通過模擬B機的升溫速率以便獲得一致擴增結果。如VertiPro PCR儀模仿Veriti、9700、C1000-touch、T100等多個品牌熱循環儀的升溫核心特征,導入被模擬對象上運行程序直接啟動實驗。
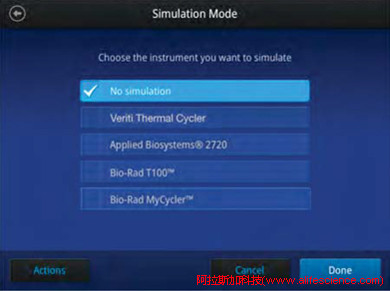
模擬功能具有向下兼容的特點,只能模擬變溫速率相對低的機型,范圍限于普通PCR儀,qPCR系統尚不適用。
(待續)















