百家秘籍
從PubMed數據看Beckman超速離心機Type 45Ti轉頭的配置與應用——蛋白的分離
Beckman Optima XPN 100/90/80、Optima XE 90/80立式超速離心機通用的Type 45 Ti鈦合金材質定角轉頭,額定工作容量6×94mL,是除Type 19角轉頭(6×250mL,19000rpm)外,單管處理量最大的超速轉頭。其實驗應用公開報道, 最早見于1978年澳大利亞費爾菲爾德傳染病醫院病毒研究人員從甲型肝炎患者糞便中分離甲肝病毒的實驗。
截止至2023年9月30日, 從PubMed期刊數據庫中共采集到Beckman超速離心機Type 45Ti轉頭有關實驗文獻336篇。從論文發表時間看, 1978 - 2003年為轉頭應用的低谷徘徊期, 2004年起,實驗應用及產出進入快速增長期。2004 - 2023這20年, 實驗論文數量出現指數級躍升。若以5年為一統計周期,則2019 - 2023年刊文數量是前40年論文總數的1.6倍之多(見圖1)。
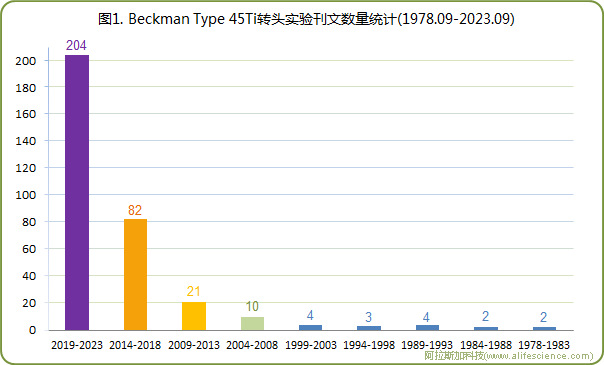
尤其值得關注的是,2014-2023這10年總計有286篇研究報告發表。所發期刊的2023年IFoid 分值(參考https://sci.justscience.cn/查詢數據)8.0分以上者達117篇。其中,包括一大批在Nature、Cell、Science、Nat Methods、Cell Discov、Nat Microbiol和Protein Cell等期刊發表的高水平論文(見表1)。
表1. Type 45Ti轉頭有關部分實驗應用刊文統計(2019.01-2023.09)
期刊名稱 | Type 45Ti應用刊文數量 | IFoid-2023分值 |
Nature | 5 | 64.8001 |
Cell | 4 | 64.5 |
Science | 2 | 56.8978 |
Nat Methods | 1 | 47.9984 |
Cell Discov | 1 | 33.5015 |
Nat Microbiol | 1 | 28.3001 |
Protein Cell | 1 | 21.1001 |
Bioact Mater | 1 | 18.9 |
ACS Nano | 2 | 17.1 |
Nat Struct Mol Biol | 1 | 16.8008 |
Nat Commun | 18 | 16.6009 |
Mol Cell | 3 | 16 |
J Extracell Vesicles | 16 | 15.9992 |
Adv Sci (Weinh) | 2 | 15.1 |
Nucleic Acids Res | 1 | 14.9 |
Nat Protoc | 1 | 14.8 |
Nat Chem Biol | 1 | 14.8 |
Alzheimers Dement (N Y) | 1 | 14 |
Sci Adv | 6 | 13.6006 |
Exp Mol Med | 1 | 12.8 |
Theranostics | 1 | 12.4002 |
Mol Ther | 1 | 12.4 |
Dev Cell | 1 | 11.8 |
EMBO J | 2 | 11.4 |
J Exp Clin Cancer Res | 2 | 11.3 |
Proc Natl Acad Sci U S A. | 6 | 11.1 |
ISME J | 1 | 11 |
Food Hydrocoll | 1 | 10.7 |
這其間高水平研究論文的占比之高,不免會引起人們的好奇與思考:如許之多有重大學術價值和廣泛影響力的研究項目中, 到底使用Type 45Ti轉頭分離何種實驗對象?
對上述117個實驗報告的相關內容歸類統計顯示:Type 45Ti轉頭的應用對象主要包括蛋白質(59例)、細胞外囊泡(EVs,44例) 和核糖體(8例)。此外,微粒體和脂質等其它亞細胞組分、病毒類(慢病毒載體、甲病毒屬Getah病毒)應用實例占比均低于2%(見圖2)。
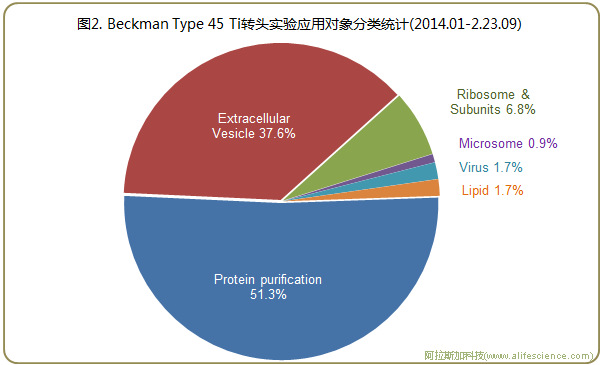
為此, 我們圍繞蛋白質、細胞外囊泡(EVs)和核糖體分離有關應用實例進行了考察, 以了解超速離心機Type 45Ti角轉頭在其中所扮演的角色。
一、Type 45Ti轉頭在蛋白分離純化中的應用
與Beckman Type 45Ti轉頭應用有關實例共計59例(BioRxiv平臺發表文章因IFloid無法查詢,不納入統計范圍)的蛋白研究存在多個維度。從蛋白在生命活動中的功能分,包括了細胞的跨膜轉運、微管運輸、胞內囊泡生物發生及轉運、蛋白的翻譯-加工修飾-折疊及定位、蛋白復合體組裝及變構、RNA轉錄和剪輯、DNA損傷修復和DNA轉座、細胞壁合成等細胞全流程生命活動。從蛋白分布定位看,有膜信號識別受體(如GPCRs)、ABC轉運蛋白,陽離子選擇性通道等各種膜離子轉運通道、核糖體新生鏈復合物(RNCs)等。
雖然不同實驗所研究對象從真核生物(哺乳動物、果蠅)、原核生物(金黃色葡萄球菌、乳酸桿菌、恥垢分枝桿菌M. smegmatis等)、擬南芥、病毒(HIV-1, 噬菌體等)、螺旋體、瘧原蟲到DNA馬達各不相同,但研究思路、方法路線相似。無論是蛋白復合體組裝、配體-受體識別、蛋白與蛋白分子或蛋白-核酸結合、抗生素作用機制或細菌耐藥機制等,無不基于對蛋白分子內部結構解析及與配體結合后構象改變進行的。統計顯示,上述59個研究項目中的36個項目的核心方法是用冷凍電鏡技術(Cryo-EM)對蛋白分子進行了3D活性構象的高分辨率分析。其余23個例是用X-ray晶體分析、電子顯微鏡技術、熒光偏振技術、單分子熒光共振能量轉移(single-molecule fluorescence resonance energy transfer,smFRET)技術等方法完成蛋白功能效應與結構基礎的分析(Structure-based mechanism)。
蛋白組分制備技術有兩種途徑:一種是從豬腦、雞肝等動物組織器官中直接提取;第二種,也是最主要的途徑,是從細菌、酵母、昆蟲細胞和哺乳動物細胞中的一種或兩種異源表達系統表達的重組蛋白進行分離純化。異源表達體系中使用最多的是原核表達系統是E. coli BL21 (DE3),占比44%,沙門氏菌、乳酸桿菌用的較少。真核類表達系統中,昆蟲細胞表達系統10例占比17%(依次是Sf9、Hi5和Sf21),其次是哺乳動物細胞中HEK293細胞系(10.1%)、酵母表達系統(8.5%)等。
1. 代表性蛋白研究應用實例
實例1 膜蛋白(受體)的提取(Joshua A. Lees, 2023)
藥物作用靶向位點、細胞之間的信號傳遞,大多是通過生物膜上的特殊膜受體蛋白實現的。約50%臨床藥物的靶向分子為膜蛋白。生物膜上的受體蛋白的表達豐度一般較低,直接在天然生物環境中難以提取到足量蛋白。由于蛋白質翻譯后還需經過修飾包括糖基化,脂肪酰化和磷酸化等修飾才能正確折疊、轉運以及與胞膜整合和定位。異源表達的受體蛋白或存在錯誤修飾、折疊導致而不具備生物活性,或表達效率不夠高效。此外,膜蛋白疏水性強,實驗條件下難以維持膜蛋白正確構象,使得對膜蛋白的結構與功能的解析相對滯后。
G 蛋白偶聯受體(G protein-coupled receptors,GPCRs)是真核生物中最大的膜蛋白超家族,分為A類視紫紅質樣受體(Rhodopsin-like receptor)、B 類分泌素受體家族(Secretin receptor family)、C類代謝型谷氨酸受體(mGlu receptor)、D 類真菌交配信息素受體(Fungal mating pheromone receptor)、E 類 cAMP環腺苷酸受體(Cyclic AMP receptor)和F類卷曲蛋白受體 (Frizzled receptor, FZD)六大類。GPCR是由7個跨膜螺旋、胞外N端、胞內C端、3個胞外環和3個胞內環的保守結構組成。胞外區域在結合激動性信號分子(如激素、神經遞質、趨化因子)后,受體構象發生變化,受體胞內區域招募并與G蛋白、P-arrestin等效應蛋白、神經遞質以及激素等特異性配體結合,通過環腺苷酸(cAMP)信號通路、磷脂酰肌醇信號通路和鈣離子信號通路等調節體內生理活動。
孤兒受體(orphan GPCR,oGPCR)屬A類GPCR,因其內源性配體尚未發現而得名。由于配體信息和配體結合靶點不明確,且孤兒受體與結構已知GPCR同源程度較低,使得對孤兒受體的結構和生物學功能研究受阻。
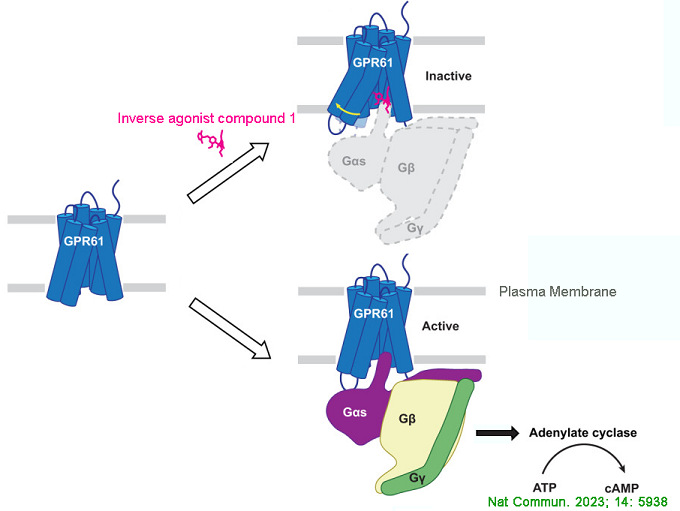
GPR61是一種與食欲相關的孤兒受體,是治療代謝和體重障礙的藥物靶標。通過構建N末端活性構象(hGPR61-dnGαs/iN18)和非活性構象(hGPR61ICL3BRIL)的重組蛋白進行人GPR61的結構表征,是對GPR61的選擇性小分子反向激動劑的結合位點和受體-配體相互作用方式研究的基礎。
用于冷凍電鏡研究的孤兒受體GPR61構建體表達蛋白的純化流程大致包括以下步驟:
【異源表達系統準備】
人GPR61在活性構象中的表達構建體(hGPR61-dnGαs / iN18)和非活性構象(hGPR61ICL3BRIL)的重組構建體被轉化為DH10Bac E. coli感受態細胞以產生表達質粒DNA,將其轉染到Sf9昆蟲細胞中以產生P0病毒。通過在無血清昆蟲細胞培養基(SF-900 III)中以2×106活細胞/ ml的密度和0.5的MOI感染1L的Sf-9細胞進行蛋白質表達。感染后當細胞的活力為80-85%時收獲細胞。
【細胞膜制備】
收集培養的Sf-9細胞沉淀,在Dulbecco磷酸鹽緩沖鹽水中室溫孵育30分鐘,添加無EDTA的羅氏cOmplete蛋白酶抑制劑片劑后, 4℃下孵育30分鐘;
將細胞用高壓均質機M-110L 15kPsi裂解細胞;
將細胞裂解物在Type 45 Ti角轉子中235000 ×g離心45分鐘,收集沉淀;
將沉淀重懸于500mM NaCl,50mM HEPES/pH 7.5中,添加無EDTA的Roche完全蛋白酶抑制劑片劑后重復上一步超速離心操作,收集沉淀;
【蛋白分離】
將沉淀重懸于含有150mM NaCl,50mM HEPES/pH 7.5,10%甘油的低鹽緩沖液中,添加無EDTA的Roche完全蛋白酶抑制劑片劑;
將粗膜提取液與1%月桂基麥芽糖新戊二醇(LMNG,Anatrace)和0.2%膽固醇半琥珀酸三鹽(CHS,Anatrace)溶解在500mM NaCl和50mM HEPES/pH 7.5,100μM TCEP中,添加無EDTA的Roche完全蛋白酶抑制劑片劑,孵育90分鐘;
【層析純化】
超速離心澄清裂解液,上樣值抗FLAG M2親和凝膠層析柱,4℃下孵育2小時;
用緩沖液(500mM NaCl,50mM HEPES/pH 7.5,100μM TCEP,0.5%LMNG和0.01%CHS)洗滌FLAG樹脂柱兩次;
使用緩沖液(0.25 mg/ml FLAG、0.01% LMNG、0.002% CHS、150mM NaCl、50mM HEPES/pH 7.5、100μM TCEP)洗脫;
將洗脫餾分合并,在離心過濾濃縮器中濃縮;
用含有0.001%LMNG,0.0002%CHS,150mM NaCl,25mM HEPES/pH 7.5,100μM TCEP的緩沖液在Superose 6尺寸排阻層析柱(SEC)上純化;
用SDS-PAGE分析餾分,收集合并單體GPR61對應餾分。
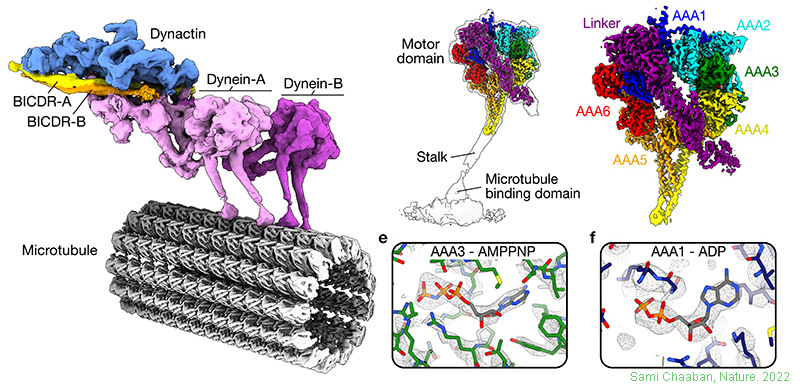
實例2 從豬腦中純化動力蛋白激活蛋白(dynactin)(Sami Chaaban, 2022)
【組織準備】
采集新鮮豬大腦,置于冰冷PBS中運輸;
將2個大腦(約200g)用冰冷PBS沖洗2遍,手動去除腦干和主要血管后,用HB緩沖液(35mM PIPES-KOH/pH 7.2, 1mM MgSO4, 0.2mM EGTA,0.1mM EDTA,1mM DTT)再次沖洗腦組織;
【組織裂解】
將大腦置于添加有3片無EDTA蛋白酶抑制劑片和1.3mM PMSF的230mL HB緩沖液中,用Waring均質器以均質15秒-停頓15秒的方式進行4個循環裂解組織細胞;
裂解物用JLA-16.250高速角轉頭16000rpm離心15min;
【蛋白分離】
上清液用Type 45 Ti轉頭4℃下45000rpm離心50分鐘,棄沉淀;
【層析純化】
在玻璃纖維過濾器和0.45μm過濾器中過濾上清液后,加載到250mL SP-Sepharose強陽離子交換層析柱上。柱預先經AKTA Pure SP緩沖液(35mM PIPES/pH 7.2, 5mM MgSO4, 1mM EGTA, 0.5mM EDTA, 1mM DTT, 0.1mM ATP)平衡;
用含3mM KCl的SP緩沖液洗滌色譜柱后,以3倍柱體積250mM KCl的線性梯度洗脫。收集15 mS/cm附近的峰并用0.22μm過濾器過濾;
濾液加至用MonoQ緩沖液(35mM PIPES, 5mM MgSO4, 100μM EGTA, 50μM EDTA, 1mM DTT, pH 7.2)預平衡的MonoQ 16/10強陰離子交換層析柱上。用MonoQ緩沖液洗柱后,先以1倍柱體積的150mM KCl的線性梯度洗脫,再以10倍柱體積的350mM KCl的線性梯度洗脫。將39 mS/cm附近的洗脫峰餾分合并濃縮至3 mg/mL;
洗脫液轉移至用添加有5mM DTT、0.1mM ATP的GF150緩沖液洗(25mM HEPES/pH 7.2, 150mM KCl, 1mM MgCl2)預平衡的TSKgel G4000SWXL凝膠過濾柱上,將114 mL處的峰合并濃縮至3 mg/mL,分成3μL等分,用液氮速凍后-80℃儲存。
實例3 金黃色葡萄球菌耐藥機制研究(J. Andrew N. Alexander, 2023)
耐甲氧西林抗生素的金黃色葡萄球菌簡稱金葡菌(Methicillin-resistant Staphylococcus aureus, MRSA)對絕大部分β-內酰胺類(β-lactamase)抗生素具有耐藥性。耐藥機制由Bla基因調控系統(由編碼β-內酰胺酶的結構基因BlaZ、啟動子調節基因BlaR1和轉錄抑制因子基因BlaⅠ組成)和MecA調控系統(由青霉素結合蛋白PBP2a的結構基因MecA、上游啟動子調節基因MecR1和轉錄抑制因子基因MecⅠ組成)介導。兩套耐藥基因系統同源(BlaR1和MecR1基因序列35%一致;BlaI和MecI序列61%相同), 且轉錄調控模式相同。
BlaR1和MecR1均為跨膜蛋白胞外部分為感受器結構域, 含有青霉素結合位點。細胞內為金屬蛋白酶結構域, 具有裂解Blal及Mecl的功能。當β-內酰胺類抗生素等誘導劑結合到BlaR1的感受器結構域, BlaR1被激活, 其胞內鋅金屬蛋白酶結構域的構象改變, 水解抑制蛋白BlaⅠ水解并使之脫離BlaZ的啟動子結合位點, BlaZ基因轉錄抑制解除, 表達產生β-內酰胺酶, 導致對β-內酰胺類抗生素出現耐藥性。與此類似,MecI抑制因子通常結合在MecA基因的啟動子部位。在β-內酰胺類藥物的作用下, MecR1被激活, 構象改變, 誘導對MecⅠ蛋白水解并從啟動子上脫落, MecA基因得以表達合成β-內酰胺類抗生素的作用靶點——合蛋白(penicillin-binding protein, PBPs) PBP2a。因PBP2a與β-內酰胺類抗生素親和力極低, 對β-內酰胺類藥物不敏感。而其所具有PBPs的完成細菌細胞壁合成功能, 卻能確保在抗生素作用下細胞壁結構的完整性。
Bla調控系統可以調控MecA基因的表達, 并且可在數分鐘內誘導PBP2a的產生。而MecA調控系統從激活到PBP2a合成則需要數小時之久。因此, Bla調控系統在許多MRSA菌株廣譜抗生素耐藥性方面作用至關重要。
研究還發現, BlaR1無需其他組分參與可直接自發切割BlaI(spontaneous autocleavage)啟動抗生素耐藥性機制。
冷凍電鏡數據表明, 耐藥性BlaR1野生型與其F284A突變體(可有效結合β-內酰胺類抗生素狀態)為異質二聚體穿膜結構。N端的鋅指金屬蛋白酶結構域在胞內, C端的可結合β-內酰胺的感受結構域位于胞外側。兩個單體間通過胞質側的α9螺旋結構連接。胞外β-內酰胺的感受結構域與另一個單體胞外部分EL1相互作用。提示了BlaR1蛋白野生型胞外結構域與β-內酰胺類藥物抗生素間還存在活性位點競爭性排斥作用。
研究表明, BlaR1中Ser283和Phe284間存在自切割環(autocleavage loop), 這個曲環通常占據胞內鋅金屬蛋白酶活性位點(F284A突變體中的自切環部位結構完整, 而野生型結構中該自切環存在未切割和切割兩種狀態)。自切割環卡位阻礙了鋅指金屬酶對BlaI、MecI轉錄抑制因子的水解, 而BlaI的二聚物狀態可穩定結合在啟動子上。當β-內酰胺結合到BlaR1胞外側的感受結構域時, 感受結構域、胞內酶活性結構域均向細胞壁靠近和構象的變化, 使自切環脫離鋅指蛋白酶活性位點。此活性位點的暴露方便了BlaI結合和水解, 耐藥基因表達抑制弱化, β-內酰胺耐藥基因表達的增加,產生耐藥效應。
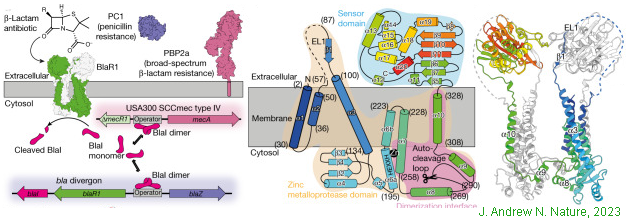
該研究項目中,針對β-內酰胺類藥物受體蛋白BlaR1的cryo-EM分析和蛋白測序應用,分別采用了兩種制備流程。
1)氨芐青霉素誘導下BlaR1構象的cryo-EM分析
【菌體準備】
4℃下離心收集菌體, 并重懸于添加了5mg/mL溶菌酶和20μg/mL DNase I的裂解緩沖液(150mM NaCl, 50mM HEPES/pH 7.5)中, 37℃攪拌、孵育1小時;
裂解液冰浴冷卻后,用高壓均質器25000 psi下裂解菌體;
將裂解物以18600×g離心30分鐘;
【細胞膜制備】
上清液用Type 45 Ti角轉頭4℃、40000rpm離心1小時, 棄上清收集沉淀;
【膜蛋白分離】
用Dounce均質器將膜沉淀重懸于添加1%(w/v)DDM的裂解緩沖液中,孵育1小時以提取膜;
用Type 45 Ti角轉頭4℃、40000rpm離心45 min后, 棄沉淀(不溶膜組分),收集上清;
上清經0.45μm濾膜過濾后, 添加咪唑至濃度20 mM/pH 7.5;
【層析純化】
裝入經平衡緩沖液處理的His-Trap HP層析柱中,分別用15mL的20mM、100mM咪唑緩沖液A各洗滌一次后, 用325 mM咪唑緩沖液A進行洗脫;
洗脫餾分用填充Sephadex G-25脫鹽柱在緩沖液A中進行脫鹽處理;
用離心濃縮器(100 kDa NMWL)濃縮;
【氨芐青霉素誘導變構處理】
用BioComp梯度大師配制輕重兩組甘油梯度緩沖液:輕緩沖液組成包括5%(v/v)甘油, 150mM NaCl, 20mM HEPES/pH 7.5加或不加0.01% LMNG洗滌劑;重甘油梯度緩沖液組成包括 25%(v/v)甘油, 150mM NaCl, 20mM HEPES/pH 7.5;
對于氨芐青霉素處理樣品, 將BlaR1(F284A)在1 mM氨芐青霉素冰上孵育約15 min, 然后用250μM氨芐西林制備所有后續緩沖液;
將150-250μL的蛋白質樣品添加于甘油梯度層上, 用SW 55 Ti水平轉頭4℃、55000 rpm離心8小時,用BioComp梯度分餾儀收集梯度餾分;
各餾分用Amicon Ultra (100?kDa NMWL)過濾器4℃下6000×g濃縮;
濃縮后蛋白組分收集于緩沖B(150?mM NaCl, 20?mM HEPES/pH?7.5)中, 用Micro Bio-Spin P-30進行脫鹽處理。
2)BlaR1自切割環位點Edmann端測序用BlaI蛋白純化
【異源表達系統準備】
將一個BlaI-麥芽糖結合蛋白(MBP)融合結構克隆到BlaI的C端, 并具有Gly-Ser-Ser連接子。N-端用10xHis 標簽設計BlaI-MBP結構, 克隆到pGEX-6P-1表達質粒中, 并轉化大腸桿菌(DE3)細胞。DE細胞在LB培養基中培養至OD600約0.6 - 0.8時,用IPTG誘導細胞表達蛋白并將培養溫度降低至20℃,過夜后收集菌體;
菌體在緩沖液3A(25mM Tris/pH 8.0和100mM NaCl)中裂解;
【膜蛋白分離】
細胞裂解液用Type 45 Ti轉頭4℃、40000rpm離心45 min;
【層析純化】
上清用0.45μm過濾器過濾后,添加咪唑至10mM濃度, 轉移至經緩沖液3A中平衡的1mL His-Trap HP親和層析柱;
用10倍柱體積、濃度2%的緩沖液3B(50?mM Tris/pH?8.0, 500?mM imidazole, 100?mM NaCl)洗柱后, 以1ml/min流速用0-100%梯度洗脫;
洗脫組分用Amicon Ultra(30 kDa NMWL)的離心過濾器濃縮;
上樣至經緩沖液3C(25mM Tris/pH 8.0,100mM NaCl)平衡處理的Superdex 75 10/300凝膠層析柱完成蛋白純化。
2. 蛋白分離中Type 45 Ti的應用優勢
資料顯示,超速離心是保持蛋白活性構象提取分離的必由之路。從操作流程上看, 無論取材于天然組織,或源于異源蛋白表達系統產生的重組蛋白,初始組織勻漿、細胞裂解液體積往往較大。對于疏水性的膜蛋白組分,往往需經歷大容量低速離心收集細胞—細胞裂解液高速離心澄清—裂解上清或沉淀重懸液的超速離心分離的過程。而MBP融合蛋白、dynactin等可溶性蛋白組分,大體積裂解液直接上樣到Type 45 Ti轉頭,只需一步操作即可將蛋白與EVs、細胞器和細胞碎片分離,獲得蛋白的粗提溶液。因此,Type 45 Ti角轉頭超速離心功能和較大的容量,正好可以大有作為。
不同蛋白理化屬性、下游應用(如cryo-EM分析與Edmann測序分析)對樣品品質要求雖有不同,但對于提取緩沖液,首先用Type 45Ti角轉頭超速離心沉淀處理是一致的基礎步驟。與核糖體、病毒類樣品分離不同,密度梯度離心環節在蛋白的提取分離中并非必須步驟。
統計表明, 同時使用角轉頭沉淀、水平轉頭密度梯度離心兩步分離的報道實例占比約1/3。先用單管容量較大的Type 45Ti角轉頭將可提取溶液上清中蛋白組分沉淀,再將沉淀轉移至容量相對較小的水平轉頭進行密度梯度分級。水平轉頭中,最常用的是容量6×38.5mL的SW 28或SW 32 Ti, 其次是容量6×13.2mL的SW 41 Ti、SW 40 Ti 或SW 32.1 Ti (6×17mL)。用容量較小的SW 60 Ti (6×4.0mL)進行純化也有報道。蛋白組分密度梯度離心使用較多的梯度介質是蔗糖。密度梯度離心耗時往往長達15-18小時, 對實驗操作、工作效率都是一種挑戰。因此,大多數報道實例中,采用的是2-3種蛋白層析柱組合的辦法取代密度梯度離心實施提取液中蛋白的純化分離。















