百家秘籍
從PubMed數據看Beckman超速離心機Type 19角轉頭的配置與應用
最高轉速13000-16000rpm、工作容量6×250 mL的高速角轉頭,如Beckman avanti系列立式高速離心機所用的JLA16.250和JA-14,Himac CR22N配屬的R13A等,常見于生物工程類實驗中培養菌體的離心收集。
Type 19轉頭額定容量6×250mL,是含Optima XPN、Optima XE系列在內的Beckman立式超速離心機轉頭中容量最大的角轉頭,最高轉速19000rpm,轉頭內部RCFmax、RCFav和RCFmin分別為53900×g、32100×g和13800 ×g(RCF的含義及計算方法可參考《Optima MAX-XP超速離心機轉頭的選擇對外泌體分離效果影響的分析》)。從轉速和RCF值看,它與JA-30.50(3000rpm;Rmax 108860×g)、JA-25.50(25000rpm;Rmax 75600×g)等同屬于高速離心機轉頭。但轉頭內部RCF強度分布極不均勻,RCF值跨度達14000 - 54000 ×g。轉頭K因子值951,遠高于JA-30.50(k因子值280)、JA-25.50(k因子值481)和JA-18(k因子值566)。可見,Type 19對納米尺度的樣品顆粒、囊泡和大分子組分的分離效率不高。那它在科研實驗中的主要應用對象是什么,實際使用率如何?
截止至2023年9月30日,合并以“Beckman[Text Word] AND Type-19[Text Word] AND rotor[Text Word]”、Beckman[Text Word] AND Type19[Text Word] AND rotor[Text Word]檢索詞的查詢結果,在PubMed期刊數據庫中共檢索到文獻記錄118+5條。逐一核實并剔除檢索詞設置所致誤差后,實得有效實驗應用文獻103篇,刊文時間為1968年11月至2023年8月(見圖1)。
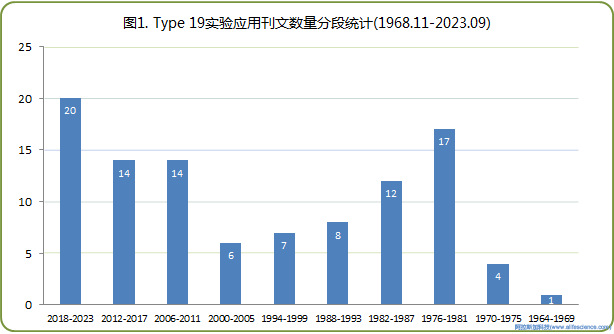
從圖上看,Type 19轉頭運用有1694-1968、2000-2005兩個低谷和1976-1981、2018-2023兩個小高潮。第二輪高潮始于2006年持續時間長,目前仍處于上升階段。
1、Type 19角轉頭在病毒類實驗中的應用
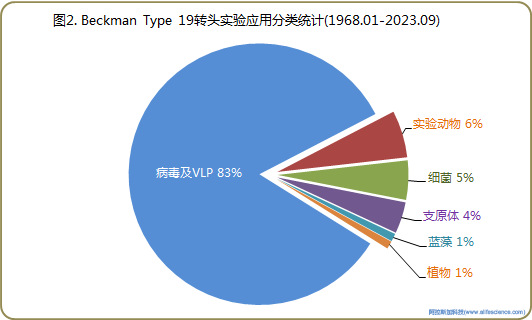
將人類和脊椎動物宿主病毒、慢病毒等病毒樣顆粒(Virus-like particle, VLPS)、疫苗生產用病毒工程載體及植物病毒、藻類病毒、細菌病毒合并為病毒類樣品后,在103個研究應用實例中,病毒類研究對象為86例(占比83.4%)。其中包括動物病毒(如免疫缺陷病毒1型、EB病毒、流感病毒、輪狀病毒、麻疹病毒、單純皰疹病毒、登革熱病毒、基孔肯雅病毒Chikungunya Virus、卡波西肉瘤相關皰疹病毒KSHV、黃病毒、狂犬病病毒等23個病毒科屬)、噬菌體、植物病毒和小球藻病毒1型。研究方向涵蓋病毒感染致病機制、診斷檢測、基因分型、功能蛋白的組裝機制、特效藥物研究和病毒疫苗開發6個方面。
1.1病毒疫苗生產流程中的應用
以流感疫苗擴增工藝為例。將高產流感病毒骨架搭載病毒HA和NA vRNA片段后克隆到pHH21載體中并轉染293T細胞,收集細胞培養液上清,接種到10日齡胚胎雞蛋中孵育48小時。采集尿囊腔中尿囊液(allantoic fluids),經4℃下3500rpm離心30分鐘澄清尿囊液,再以Tyep 19角轉頭18500 rpm4℃離心2小時。收集沉淀并重懸于5mL PBS中,用相同轉頭、離心條件經線性蔗糖密度梯度(20%-30%-35%-40%-45%和50%)純化后,收集病毒條帶用PBS稀釋,進一步以SW32 Ti水平轉頭4℃下25000rpm離心2小時除去蔗糖溶液采集病毒沉淀用于后續滅活處理。
1.2 病毒感染機制研究的應用
基孔肯雅熱病毒(Chikungunya virus,CHIKV)是一種由蚊蟲叮咬傳播的有包膜的單股正鏈RNA病毒。CHIKV主要通過網格蛋白介導的內吞作用((endocytosis))進入宿主細胞,被吞噬到內體(endosomes)中。內體的低pH環境觸發病毒表面蛋白構象變化,包膜和內體膜發融合形成融合孔,病毒核衣殼藉此通道進入胞質,并被分解以釋放病毒RNA并啟動復制。用冷凍電鏡斷層成像技術(cryo-electron tomography, cryo-ET)和子斷層圖像平均技術(sub-tomogram average, STA)結合的方法,可在接近天然的條件下對病毒粒子結構變化、糖蛋白構象以及膜融合過程進行捕獲和觀察。
CHIKV病毒S27毒株的制備和純化過程是:BHK-21細胞在補充有10% FBS的DMEM培養基中以37℃培養,在細胞病毒感染復數(multiplicity of infection, MOI)為4.0時染毒處理1.5小時。繼續培養25-27小時后收集培養基,用type 19角轉頭4℃下53791×g離心2小時將沉淀病毒,隨后在HNE緩沖液中重懸,在蔗糖密度梯度液中用SW 41Ti水平轉頭4℃下68405xg離心過夜,提取純化的病毒條帶。
1.3 病毒致病機制研究應用
卡波西肉瘤相關皰疹病毒(Kaposi's sarcoma-associated herpesvirus, KSHV)基因組中K15編碼的KSHV非結構膜蛋白招募并激活幾種細胞蛋白,包括磷脂酶Cγ1(PLCγ1),NF-κB途徑的組分以及SRC家族的非受體酪氨酸激酶(Non-receptor tyrosine kinase,NRTK)成員,在炎癥信號途徑激活中發揮重要作用。為鑒定參與pK15炎癥激活途徑的細胞成分,從KSHV感染的內皮細胞中免疫沉淀pK15,并通過無標記定量質譜鑒定了相關蛋白質。研究發現:II類磷脂酰肌醇3激酶(PI3K-C2α)參與活化受體酪氨酸激酶的內吞作用及胞內細胞器的信號傳導,與核周區域富集囊泡結構中的pK15發生共定位。分析表明,PI3K-C2α有助于PLCγ1和Erk1/2的pK15依賴性磷酸化,并在 KSHV 裂解復制中發揮作用。
重組病毒rKSHV.219的制備方法為:在 2.5μg/ml 抗人 IgM 抗體存在下,BJAB-rKSHV.219細胞在轉瓶中培養4-5天后收集細胞培養物,先低速離心去除培養基中細胞和碎片,將上清0.45μm過濾器過濾后,濾液在Type 19角轉頭中4℃下15000rpm離心5小時。收集病毒沉淀,重懸于EBM-2MV培養基中作為HEK-293細胞病毒感染源。
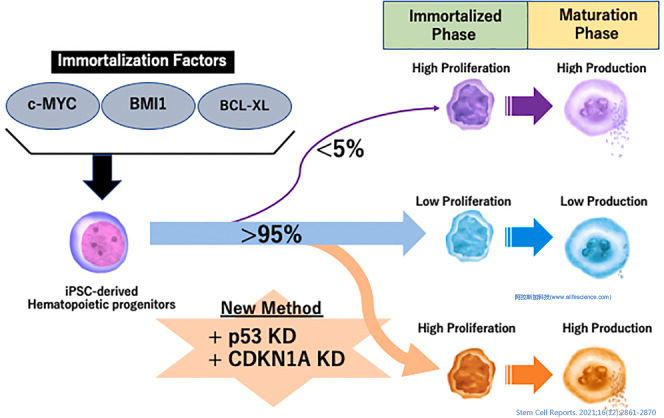
1.4 慢病毒載體介導的基因敲除應用
MYC、BMI1和BCL-XL(MBX)是已知的與細胞分化、增殖和凋亡調控有關的功能基因。p53是干細胞基因組質量監控分子,可在轉錄水平上抑制MBX等調控網絡關鍵基因的表達,使多能干細胞(Pluripotent stem cells,PSCs)快速啟動分化和凋亡。
細胞周期蛋白依賴性激酶2 (cyclin-dependent kinase 2,CDK2)和CDK4主要作用于細胞周期的G1期和S期。活化的cyclin與CDK組成的蛋白激酶復合物,促使細胞通過G1/S檢驗點進入S期,啟動DNA復制,誘發有絲分裂,驅動細胞分裂增殖。而CDK抑制劑(CDKIs)則可抑制cyclin--CDK復合物的活性。
科研人員通過強力霉素(Dox)誘導MYC、BMI1和MBX表達手段已建立了人多能干細胞(hPSC)衍生的巨核細胞祖細胞(imMKCLs)體系以應對血小板制品短缺問題。但imMKCLs存在增殖潛能低的問題。而MKCL細胞基因表達譜分析發現,CDKIs的過表達與MKCL增殖潛能呈負相關。通過誘導MYC/BMI1/BCL-XL調控基因的過表達并沉默CDKN1A和p53,可穩定誘導imMKCLs產生血小板。
針對CDKN1A和p53的基因沉默用的是攜帶有靶基因shRNA序列慢病毒載體轉染的方法。
為提取保存于HEK293T細胞中shCDKN2A-GFP和shp53-GFP慢病毒載體,使用Optima L-100 XP超離心機Type 19角轉頭4℃下19000rpm離心4.5h沉淀病毒載體后用于下一步基因敲除操作。
1.5 病毒類樣品分離基礎操作步驟
無論是病毒基因組結構分析、蛋白結構及組裝、抗原特征分析或慢病毒介導的基因敲除應用,都離不開病毒/病毒載體的分離純化。
以培養細胞作為初始源材料的病毒樣品的分離流程,通常包括以下兩個基本操作:
1)將染毒細胞培養基收集,4℃低速離心去除細胞及細胞碎片,澄清上清;
2)上清用Type 19轉頭高速沉淀病毒顆粒。
86個病毒類研實例中離心轉速/RCF及離心時間信息可查的有效記錄78例。
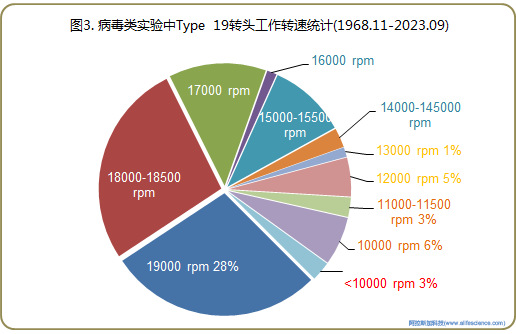
含病毒顆粒的細胞培養上清液的高速沉淀操作環節,Type 19轉頭轉速設定為15000rpm-19000 rpm有62例(RCFav 21000 - 33000×g)。另有14例報道中,沉淀病毒所用轉速介于8000-14100 rpm(RCFav相當于6200 - 18700×g)。
對比Beckman Type 19、Avanti系列立式高速離心機配屬的高效角轉頭JLA16.250、JA-14的工作性能參數(見表2)可知,當Type 19轉頭的工作轉速降低至14000rpm時,轉頭內部RCF強度、分離效能(參考K因子值)已跌至JA-14轉頭水準,低于JLA16.250轉頭離心性能。
表1. Beckman Type 19角轉頭不同工作轉速下轉頭RCF值分布表
工作轉速 | RCFmax | RCFav | RCFmin | K因子值 |
19000 rpm | 53900 ×g | 32100×g | 13800 ×g | 951 |
18000 rpm | 48300 ×g | 30300×g | 12400 ×g | 1004 |
17000 rpm | 43140 ×g | 27100×g | 11100 ×g | 1063 |
16000 rpm | 38200 ×g | 24000×g | 9800 ×g | 1129 |
15000 rpm | 33500 ×g | 21100×g | 8600 ×g | 1205 |
14000 rpm | 29200 ×g | 18300×g | 7500 ×g | 1291 |
13000 rpm | 25200 ×g | 15800×g | 6500 ×g | 1390 |
表2. Beckman Type 19與Avanti系列 高效角轉頭間工作性能參數對比表
轉頭型號 | Type 19 | JLA16.250 | JA-14 | JA-18 | |||
額定容量 | 6×250 mL | 6×250mL | 6×250 mL | 10×100mL | |||
額定轉速 | 19000 rpm | 14000 rpm | 12000 rpm | 10000 rpm | 16000 rpm | 14000 rpm | 18000 rpm |
RCFmax | 53900 ×g | 29200 ×g | 21490 ×g | 14920 ×g | 38400 ×g | 30100 ×g | 47900 ×g |
RCFav | 33862 ×g | 18300 ×g | 13510 ×g | 9380 ×g | 25700 ×g | 18800 ×g | 35400 ×g |
RCFmin | 13890 ×g | 7500 ×g | 5540 ×g | 3840 ×g | 13170 ×g | 7670 ×g | 23200 ×g |
K因子值 | 951 | 1291 | 1506 | 1807 | 1090 | 1764 | 566 |
病毒沉時間方面,有49例設定的離心時間為2-6小時(占比超過60%)。而離心時間≤1.5小時或≥8小時的總數為29例。
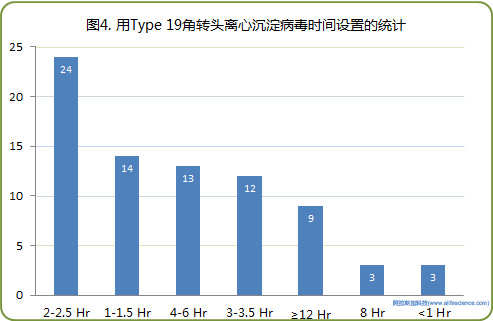
2、Beckman超速離心機Type 19角轉頭在非病毒類實驗研究中應用
Type 19角轉頭在非病毒類實驗應用僅16例,涉及解脲支原體、胞體、細胞器、細胞外囊泡、蛋白和受體等的分離。
2.1 胎盤滋養層細胞膜的制備
胎盤粗膜制備流程基于1982年Pearse B. M報道的方法修改而來:采集新鮮的足月分娩產婦胎盤,去除淺膜、血管和臍帶后切成碎末,在冰冷 Tris-HCl 緩沖液中沖洗去除血污后,在添加蛋白酶抑制劑的2倍體積囊泡緩沖液(0.15M NaCl, 1 mM EGTA, 0.5 mM MgCl2, 0.02% NaN3, and 0.2 mM phenylmethylsulfonyl fluoride)中,用Waring攪拌機以最高速度勻漿1分鐘,用JA-10角轉頭4℃下5000rpm離心30分鐘棄沉淀,上清添加10U /mL胰RNA酶、室溫下孵育30分鐘,在Type 19角轉頭中4℃19000rpm離心3小時,制備粗膜沉淀(注:原方法為4℃下RCF 55000×g離心1小時。而Type 19最大RCF僅53900×g)。
2.2 以牛主動脈制備微粒體(Microsomes)
12-15條主動脈(aortae)在3L咪唑(imidazole)勻漿緩沖液(0.3 M蔗糖,5mM咪唑鹽酸鹽,pH 7.4)中室溫解凍后,將平滑肌層分離,用絞肉機絞碎。取1250g碎末在250 mL咪唑勻漿液中用Waring攪拌機以最大速度勻漿90秒。勻漿液用JA-10轉頭8000 rpm離心20分鐘,收集上清同時收集沉淀。將沉淀重懸于含1mM MgATP的250mL咪唑勻漿液中,重復一次均質和離心操作。將前后兩次勻漿液離心所得上清通過四層粗棉布過濾,用type 19轉頭19000 rpm離心2小時或在JA-14轉頭中14000 rpm離心3小時。收集沉淀,在300mL 0.3M蔗糖/20mM焦磷酸鈉/20mM磷酸二氫鈉/imMMgCl2/0.5mMEDTA(pH 7.1)中重懸,經第三次均質、離心,收集并過濾上清液后,用type 19轉頭19000 rpm離心2小時,收集的富含微粒體的沉淀組分備用。
2.3 解脲支原體16S rRNA基因提取分離
從broth cultures培養基中將處于對數生長期的解脲原體(Ureaplasma)收集,胞體用SDS裂解、RNase酶和蛋白酶K處理,用苯酚、苯酚-氯仿和氯仿提取分離DNA。添加乙酸鈉和乙醇后用L5-50超速離心機Type 19轉頭20000×g離心25分鐘沉淀,獲得解脲支原體DNA。
2.4 植物蛋白酶抑制劑的提取
收集受傷番茄葉子,用液氮速凍后凍干,在Waring均質機中研磨3分鐘。將8.5 g葉片粉末與 170 mL提取緩沖液(0.1 M K-磷酸、0.3 M KCI 和 3 mm 焦亞硫酸鉀,pH 6.5)混合,用磁力攪拌器輕輕攪拌 5 分鐘后,用Type 19轉頭33456×g離心15分鐘澄清,所得上清即蛋白酶抑制劑粗提物。
3、關于Beckman 超速離心機配置使用Type 19角轉頭的討論
3.1 Type 19角轉頭的主要應用定位問題
資料表明,Beckman立式超速離心機的Type 19角轉頭設計定位于大容量高速離心,在病毒學研究應用,特別是以培養菌體、細胞為初始樣品材料的病毒類樣品研究、病毒疫苗和治療特效藥物的開發方面應用,是科學合理的。采用Type 19轉頭將病毒顆粒從大體積(800mL-1600mL)樣品中通過15000rpm以上高速離心的初步沉淀,再結合容量稍小的VTi 50.1垂直轉頭、NVT 65近垂直轉頭或水平轉頭SW 55 Ti、SW 41 Ti及SW 32 Ti等完成病毒密度梯度純化,可實現工作流程的無縫銜接,十分便捷。此外,Type 19轉頭還可兼顧藍藻、支原體和細菌等微生物顆粒的收獲、組織細胞勻漿液的澄清和亞細胞組分的分離實驗應用。正因為此,Type 19角轉頭從Spinco L系列超速離心機起,雖經歷Model L2、L3、L4、L5、L7、L8 、Optima L-XP直至Optima XPN、Optima XE的更新換代,卻歷久彌新,沿用至今。隨著基因治療技術應用的拓展、AAV等工具載體技術改進和病毒性傳染病防治研究的深入,這一經典轉頭的應用將會迎來新一輪高光時刻。
Type 19轉頭為常規鋁合金材質轉頭,滿載情況下重達17公斤。在超速離心機上操作此般體量的轉頭,載樣重量精細配平、轉頭安裝精準就位與拆卸時輕拿輕放,無論對實驗者或超離管理人員,其安全風險不容忽視。因此,預算條件受限時,Type 19轉頭通常不會作為優先配置的選項。
盡管Type 19轉頭上市和應用已數十載,但迄今為止,在PubMed期刊文獻報道中出現次數不過區區103次。其普及程度不僅遠低于Type 90 Ti、Type 70 Ti、Type 45 Ti等Beckman立式超速離心機所屬的同類角轉頭,被公開報道的使用頻次甚至不及VTi 50、NVT 65等新型轉頭(見圖5)。Type 19宛然成了超速離心轉頭中偏安于一隅的小眾。
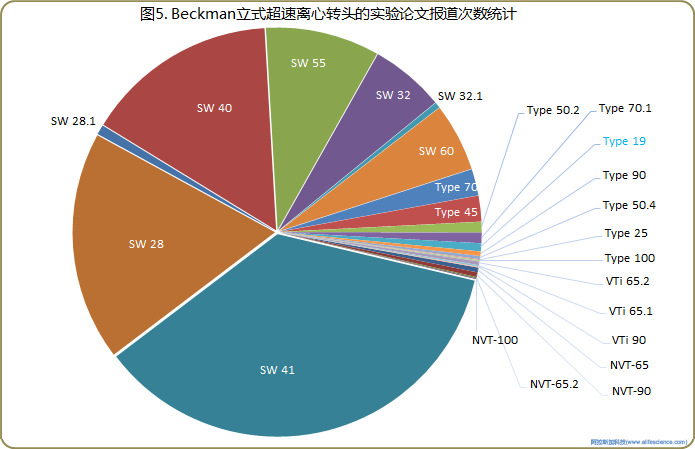
與相同功能定位的JLA-16.250、JA-14比,在離心轉速不高于14000rpm的應用環境下, Type 19轉頭毫無效能優勢可言。
2000.01-2.23.09期間JLA-16.250與Type 19在PubMed期刊刊文報道出現頻次的分段統計(見圖6)顯示,近10余年,新型輕質J-LITE JLA-16.250轉頭(空重僅10.3公斤)有關的發文數量和報道的增長幅度,均已后來居上。
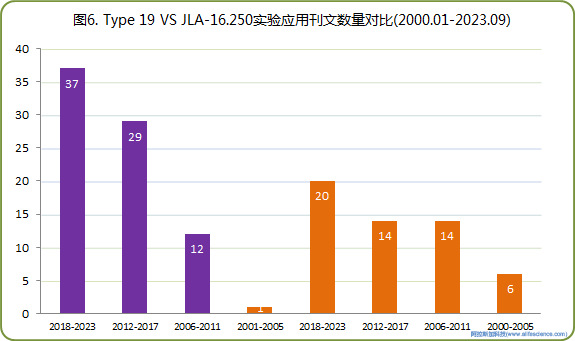
3.2 對Type 19轉頭工作條件設置的準確描述問題
多年來,對離心機和轉頭的資料上傾向于強調轉頭的最高轉速、最大RCF和最大工作容量指標,無意中忽視了轉頭的Rav、Rmin及K因子值等性能參數。這一做法對實驗者的消極影響有2方面。一是概念上的誤解,二是轉頭工作參數設定的困擾。
轉頭標示的最大相對離心力(注:RCF為最大離心加速度值或最大離心力場強,相對離心力為習慣法),是轉頭工作時產生的RCF理論極限值。在剔除離心管/瓶壁厚度、配套適配器壁厚度后,轉頭實際最大RCF值要小轉頭額定RCF值,且RCFmax只適用于離心管底部最外側這一極小范圍,除此之外管內任一位置樣品所承受的實際RCF強度都不使用。樣品管內大部分區域內樣品所承受的RCF強度均小于RCFmax。與Rmax位點越遠,樣品工作有效RCF越小。
Beckman離心機控制系統是基于對轉速精準控制計算出轉頭對應的RCFav。Type 19以額定最高轉速運行時,系統計算顯示的RCF值33860×g為RCFav而非RCFmax。事實上,該轉頭是無法按設定RCF=54000×g的要求來運行的,RCF值只能設定為不高于33900×g。但應用實例中,將Type 19轉頭工作RCF值報告為54000×g、53000×g、48500×g、35000×g的錯誤不在少數。
只關注RCFmax而忽視影響轉頭分離效能的RCFav、Rmin這兩個關鍵技術指標,容易誤導實際工作中對轉頭轉速或RCF設定。當Type 19轉頭以12000rpm轉速運行時,轉頭RCFmax達到21000×g,但離心瓶內部RCFav 大小約13500 ×g,RCFmin強度更是低至5540 ×g。此時,離心瓶內側樣品承受的RCF值介于5540 - 13500 ×g。10000×g以內RCF強度,通常被認為難以將病毒顆粒從培養基中有效、完整沉淀。而實驗報告中Type 19轉頭RCF設定為100000×g或9846×g用于病毒沉淀,明顯有誤。
美國衛生與公眾服務部公共衛生服務疾病控制和預防中心Gwong-Jen J. Chang等對組織細胞培養基中VLPs離心操作參數是這樣描述的:在Beckman Type 19轉頭中4℃下19000rpm離心過夜,從轉染質粒pCB8SJ2的中國倉鼠卵巢(Chinese hamster ovary, CHO)細胞培養基中濃縮分泌的抗原,并重懸于TNE緩沖液(50mM Tris,100mM NaCl,10mM EDTA,pH 7.5)至原始體積的1/200。據文中轉頭型號、工作轉速和離心時間、離心溫度信息,讀者運用于同類實驗離心工作條件設置和優化。此外,亦可標注主機型號、轉頭型號和RCF設定值替代轉頭型號及工作轉速信息。
3.3 病毒類樣品沉淀操作中Type 19替代轉頭選擇問題
當進行AAV或慢病毒載體和VLPS等病毒類樣品沉淀分離、微粒體等亞細胞組分制備等對RCF有較高要求離心實驗,而手頭無Type 19轉頭可用時,基于Type 19轉頭RCFav值34000×g、RCFmin值14000×g的特點,可有兩種轉頭替代方案。
首選是Avanti J-E、Avanti J-26XP、Avanti J-XN 26和Avanti J-XN 30立式高速離心機JLA-16.250方案:轉速16000rpm,并適度延長離心時間。
其次是Type 45角轉頭方案:用94mL Quick-Seal Ultra-Clear或81mL thickwall超速離心管,轉速28000rpm,每輪可完成900-1000mL樣品濃縮處理。
當Type 45、JLA-16.250兩款轉頭都無法獲取時,還可采用JA-18轉頭方案:采用100mL Ultra-Clear超速離心管或94mL離心瓶,轉速18000rpm,參考原Type 19離心時間設定或適度縮短時間,每輪運行離心940-1000mL樣品。
參考文獻
[1]Lizheng Guan, Jihui Ping, Tiago J. S. Lopes, et al. Development of an Enhanced High-Yield Influenza Vaccine Backbone in Embryonated Chicken Eggs. Vaccines (Basel) 2023 Aug; 11(8): 1364.
[2]Mangala Prasad, Jelle S. Blijleven, Jolanda M. Smit, et al. Visualization of conformational changes and membrane remodeling leading to genome delivery by viral class-II fusion machinery. Nat Commun. 2022; 13: 4772.
[3]Bizunesh Abere, Naira Samarina, Silvia Gramolelli, et al. Kaposi's Sarcoma-Associated Herpesvirus Nonstructural Membrane Protein pK15 Recruits the Class II Phosphatidylinositol 3-Kinase PI3K-C2α To Activate Productive Viral Replication. J Virol. 2018 Sep 1; 92(17): e00544-18.
[4]Masamitsu Sone, Sou Nakamura, Sachiko Umeda, et al. Silencing of p53 and CDKN1A establishes sustainable immortalized megakaryocyte progenitor cells from human iPSCs. Stem Cell Reports. 2021 Dec 14; 16(12): 2861–2870.
[5]Rawshan Choudhury, Aipo Diao, Fang Zhang, et al. Lowe Syndrome Protein OCRL1 Interacts with Clathrin and Regulates Protein Trafficking between Endosomes and the Trans-Golgi Network. Mol Biol Cell. 2005 Aug; 16(8): 3467–3479.
[6]Pearse, B. M. Coated vesicles from human placenta carry ferritin, transferrin, and immunoglobulin G. Proc Natl Acad Sci U S A. 1982; 79(2): 451–455.
[7]C. C. Chadwick, A Saito, S Fleischer. Isolation and characterization of the inositol trisphosphate receptor from smooth muscle. Proc Natl Acad Sci U S A. 1990 Mar; 87(6): 2132–2136.
[8]Thomas E. Cleveland, Lowell L. Black. Partial Purification of Proteinase Inhibitors from Wounded Tomato Plants. Plant Physiol. 1982 Feb; 69(2): 537–542.
[9]David E. Purdy, Amanda J. Noga, Gwong-Jen J. Chang. Noninfectious Recombinant Antigen for Detection of St. Louis Encephalitis Virus-Specific Antibodies in Serum by Enzyme-Linked Immunosorbent Assay. J Clin Microbiol. 2004 Oct; 42(10): 4709–4717.















