百家秘籍
赤橙黃綠青藍紫 誰持彩練當空舞——激酶活性HTRF檢測的熒光酶標儀方案-上
基于應用的多功能熒光酶標儀選型-3
均相時間分辨熒光技術(Homogeneous Time-Resolved Fluorescence,HTRF) 是法國Cisbio公司(2019年并入美國PE)融合熒光共振能量轉移(Fluorescence Resonance Energy Transfer,FRET)和時間分辨熒光(Time-Resolved Fluorescence, TRF)兩種技術基礎上創建的一種TR-FRET分析方法。最早的報導見于G Mathis在1993年9月Clin Chem (IF 12.1670)的《Rare earth cryptates and homogeneous fluoroimmunoassays with human sera》一文。
HTRF、FRET及TR-FRET分析技術,研究的都是納米尺度空間內兩種或多種生物分子間的特異性相互結合、相互作用的關系。但HTRF技術在測試穩定性、靈敏度、簡便性和高通量兼容性上,具有特殊優勢。在制藥企業、科研院所藥物研究中心的新藥研發中,HTRF已成為開展藥物靶標結合的動力學分析、高通量高親和力化合物篩選最受歡迎方法之一。
生物醫學科研實驗,HTRF技術在受體與配體、蛋白與蛋白、蛋白與核酸間的結合及作用機制分析等得到廣泛應用。它是激酶活性檢測,如絲氨酸、蘇氨酸激酶(serine/threonine kinases,STK)活性檢測、細胞膜G蛋白偶聯受體(G-Protein Coupled Receptor, GPCR)的信號轉導機理(如G蛋白級聯反應/G-protein cascades)和功能分析(細胞中IP1或cAMP定量),蛋白質-蛋白質相互作用(protein-protein interaction, PPI),基因表達調控,表觀遺傳學(如組蛋白修飾活性),細胞因子,炎癥、代謝性疾病及神經系統疾病中異常信號通路生物標志物分析(如人腦tau蛋白聚集)等研究的重要手段。
2019年以來,幾乎每年Acta Pharm Sin B都有HTRF應用文章發表。2022.01-2022.08,就已刊發了多篇中國醫學科學院北京協和醫學院、清華大學、沈陽藥科大學、中山大學科研團隊的HTRF檢測應用有關報告。
本文嘗試討論以下4個問題:1)HTRF技術對其它同類熒光測定方法的獨特優勢;2)HTRF技術對測試儀器有何特殊要求;3)將HTRF技術用于激酶活性分析等分子互作實驗過程中多功能熒光酶標儀的選型策略;4)HTRF與其他TR-FRET測定技術在檢測程序上的兼容性。
一、HTRF分析與TRF、FRET、TRF-FRET技術和而不同
青取之于藍而青于藍,冰水為之而寒于水。
HTRF技術源于TR-FRET技術,但在TRF鑭系元素熒光材料應用、FRET近紅外熒光標記的選擇和熒光信號校正方法三方面都有重大創新發明。
1.1 新型鑭系陽離子穴狀化合物熒光供體的應用
鑭系元素也稱稀土元素(Rare earth element),如銪(europium, Eu)、鋱(terbium, Tb)、釤(samarium, Sm)等,對紫外可見光吸收弱,難以被直接激發產生檢測效用的熒光。通過鑭系陽離子自身的配位化學鍵,與有紫外吸收功能的有機化合物配體結合,組成中心為鑭系陽離子、外圍為有機配體、具有特殊構象的配位化合物。外圍配體吸收紫外輻射能量后傳遞給位于中心的鑭系陽離子,后者即可發射斯托克位移(Stoke's shift)大、峰形窄,壽命長的熒光(這種現象稱為“天線效應”)。
三價陽離子Eu3+ 、Tb3+ 、Sm3+的配位數多達8-9個。不同配體與鑭系陽離子構成的配位化合物復合體構象存在復雜多樣性。不同復合體空間構象在減少周圍介質環境發光淬滅效應、維持熒光穩定性效用存在差別。
而樣品溶液中的生物大分子(如核酸、蛋白質芳香殘基),乙二胺四乙酸(EDTA)、具有環狀結構的有機配體等,或因與鑭系陽離子結合敏化鑭系陽離子發光,或因淬滅作用,會改變熒光發射特性。
常規TRF分析中的熒光標記物多為Eu3+、Tb3+螯合物(Chelates)。復雜樣品基質成分干擾,溶液溫度和pH值條件的波動、高濃度的Mg2+等金屬陽離子以及EDTA、二甲基亞砜(DMSO)等添加劑的存在,常導致鑭系元素螯合物熒光檢測信號很大不穩定。
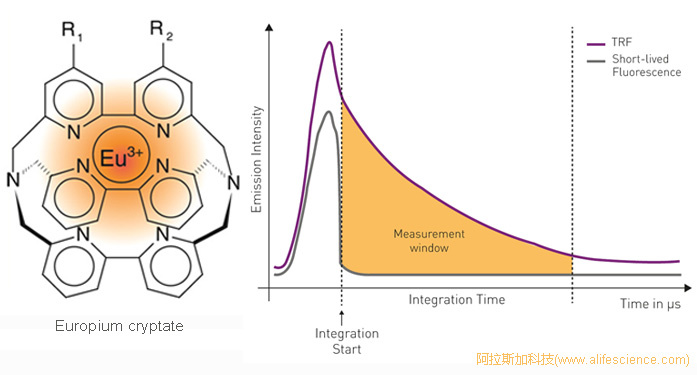
HTRF技術的FRET熒光供體為有特殊空間構象的穴狀化合物Eu3+ cryptate、Tb3+ cryptate。它們是以含2,2'-聯吡啶基團(2,2’-bipyridine groups)的巨多環(macropolycycic)外圍骨架作光吸收配體、中央空腔嵌入鑭系元素離子構成的。其籠狀結構可為結構中心的Eu3+ 、Tb3+離子提供強大保護。而聯吡啶基團的結合有助于分子內高效能量轉移和提升量子效率。特別是采用Eu3+內核時,標記物在生物介質中具有優良的動力學穩定性,對樣品基質和溶液成分的耐受力極強。無熒光漂白現象,可允許連續數日對同一樣品進行多次重復測定。因此,不僅可用于熒光強度的終點測定(Endpoint measurement),還適用于樣品熒光的動力學分析(kinetic measurement)。這是普通鑭系元素螯合物TRF試劑難以實現的。
1.2 高效能FRET能量受體XL665和d2的應用
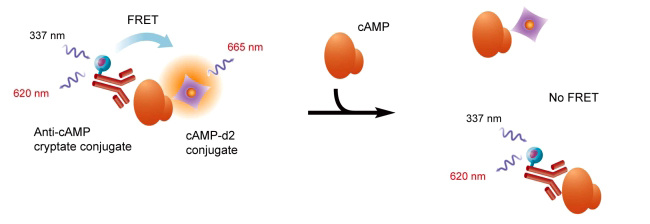
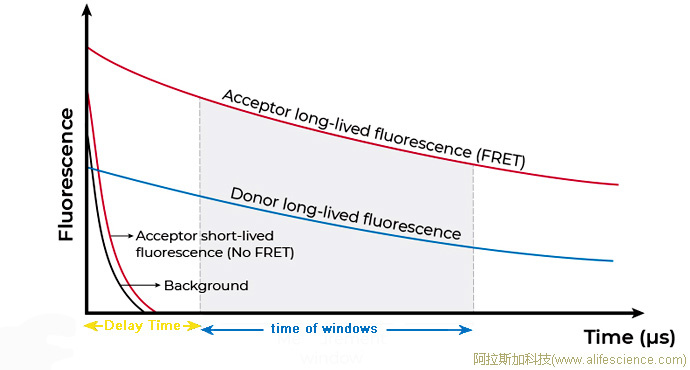
熒光共振能量轉移(FRET)利用能量供體(Donor)、能量受體(Acceptor)兩種熒光基團,分別標記有可能相互結合的兩個生物分子。生物分子發生結合后,其攜帶的Donor、Acceptor得以靠近到10nm以內。此時,供體與受體之間產生能量共振轉移,供體部分能量轉移給了Acceptor,后者吸收能量即發射熒光。樣品將會被同時檢測到兩種熒光信號:一種是能量供體被檢測光源激發后釋放的強度較強、峰值620nm熒光,另一種是受體發出的強度較弱、峰值665nm紅色(或520nm的綠色)熒光。相反,如待測的兩種生物分子間未發生結合,標記供體、受體的兩個熒光基團因空間距離過大將無法發生FRET,受體將處于靜默狀態,無熒光釋放,此情況下,只檢測到發自供體的一種熒光。
FRET技術優勢在于,實驗中無需將未結合的、游離狀態的檢測分子移除,無需洗板步驟直接測定,簡化了操作,且有利于整合移液工作站、儲板機和多功能熒光酶標儀,實現全程自動化、高通量FRET檢測。
HTRF技術中,FRET熒光受體有兩種,即XL665和d2。二者分子量不同,熒光光譜特征完全相同:不僅半衰期非常長,激發波長620 nm,發射波長665 nm,Stroke's shift > 300 nm,發射光譜處于紅外區,可進一步降低生物溶液中其它生物分子本底熒光干擾。XL665即別藻藍蛋白(Allophycocyanin, APC)為超靈敏熒光染料,具有極高的量子產率,比傳統有機熒光團靈敏度高百倍。d2是第二代FRET能量受體用熒光標記物,分子量較小,可減少空間位阻對實驗的影響。
1.3 FRET雙熒光比值校正法的應用
HTRF與其它TR-FRET產品的區別還在于對兩種熒光測試值的專利比值處理方法。
測定620 nm供體和 665 nm受體發射的兩種熒光強度后,用665/620(受體/供體)的比率計算Delta F(%),表示每個樣本的FRET能量轉移率。
專利的比值測量校正了孔與孔間因移液誤差所致的樣品填充量差異、不同樣品濃度或測量儀器激發能量波動引起的誤差,并消除來自測定組分的介質干擾和淬火帶來的干擾。這個歸一化處理措施,提高了靈敏度并降低測試值的CV%。(待續)















