百家秘籍
蛋白提取純化的幾種常用方法
蛋白質的分離純化在生物化學研究應用中使用廣泛,是一項重要的操作技術。
蛋白提取包括總蛋白提取、總膜蛋白提取、胞漿蛋白提取、細胞核蛋白提取等,分離的蛋白不僅可以用于研究蛋白在細胞內的定位,還可以用于下游的功能研究,比如轉錄調控、信號轉導、酶活分析等。
不同的蛋白質在它們的許多物理、化學和生物學性質有著極大的不同,這些性質是由于蛋白質的氨基酸的序列和數目不同造成的,連接在多肽主鏈上氨基酸殘基可是荷正電的、荷負電的、極性的或非極性的、親水的或疏水的,此外多肽可折疊成非常確定的二級結構(α螺旋、β折疊和各種轉角)、三級結構和四級結構,形成獨特的大小、形狀和殘基在蛋白質表面的分布狀況,利用待分離的蛋白質與其他蛋白質之間在性質的差異,即能設計出一組合理的分級分離步驟。
一、超速離心法
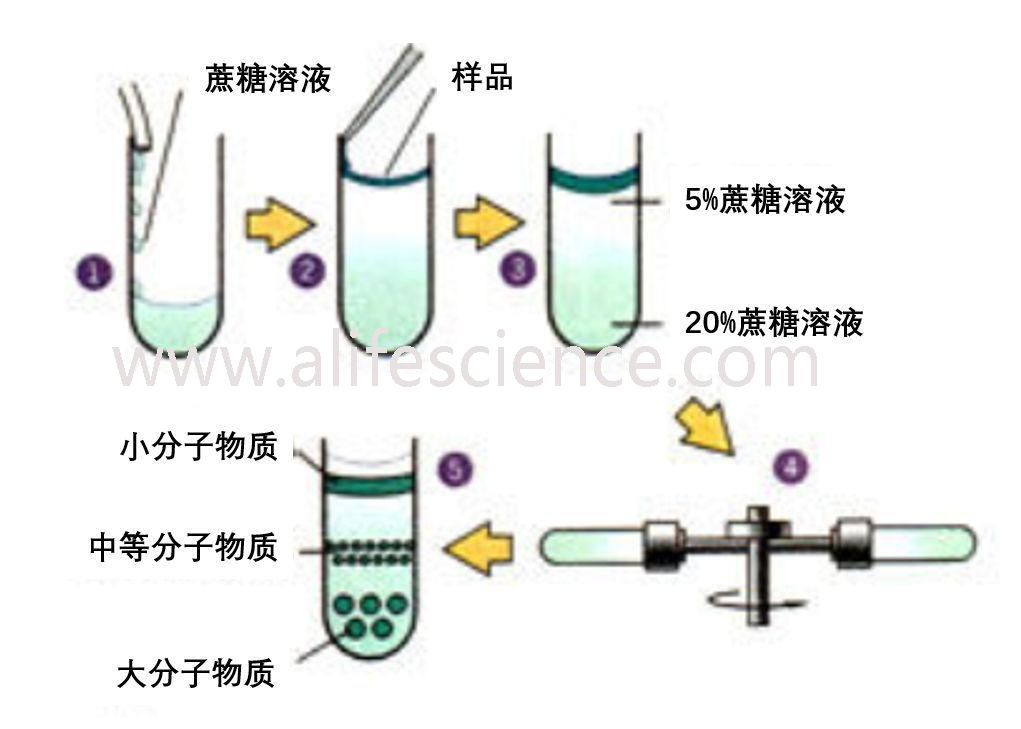
超速離心分離法用于分離亞細胞成分和蛋白質,是進一步純化的第一次過篩。此法分離和純化抗原的原理是利用各顆粒在梯度液中沉降速度的不同,使具有不同沉降速度的顆粒處于不同密度梯度層內,達到彼此分離的目的。常用的密度梯度介質有蔗糖、甘油、CsCl等。Beckman Avanti J-26S XPI、賽默飛Multifuge X4R Pro、eppendorf 5810R、日立CR-22N等立式低溫高速大容量離心機,賽默飛Multifuge X1R、eppendorf 5804R等多功能高速離心機、Heraeus Fresco 17 Fresco 21、eppendorf 5424R等微量高速離心機離心機均可滿足這個功能需求。
二、選擇性沉淀法
選擇性沉淀是采用各種沉淀劑或改變某些條件促使抗原成分沉淀,從而達到純化的目的。
1、鹽析沉淀法
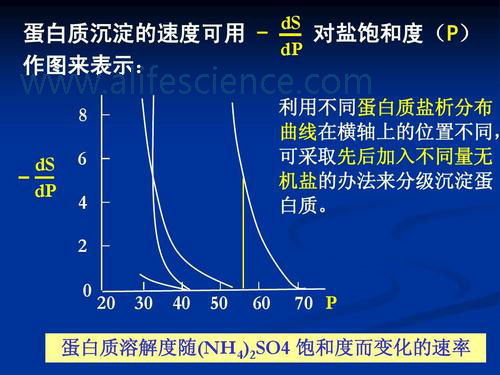
這是最古老而又經典的蛋白質純化分離動技術。由于方法簡便、有效、不損害抗原活性等優點,至今仍被廣泛應用。蛋白質在水溶液中的溶解度取決于蛋白質分子表面離子周圍的水分子數目,亦即主要是由蛋白質分子外周親水基團與水形成水化膜的程度以及蛋白質分子帶有電荷的情況決定的。蛋白質溶液中加入中性鹽后,由于中性鹽與水分子的親和力大于蛋白質,致使蛋白質分子周圍的水化層減弱乃至消失。同時,中性鹽加入蛋白質溶液后由于離子強度發生改變,蛋白質表面的電荷大量被中和,更加導致蛋白質溶解度降低,使蛋白質分子之間聚集而沉淀。由于各種蛋白質在不同鹽濃度中的溶解度不同,不同飽和度的鹽溶液沉淀的蛋白質不同,從而使之從其他蛋白分離出來。常用的鹽溶液是33%~50%飽和度的硫酸銨。
鹽析法簡單方便
(1)抗原的粗篩:用不同飽和度的硫酸銨或硫酸鈉可將一個復雜的組織液吩成若干組分,也可收集某一飽和度的鹽析沉淀物作為進一步純化的粗篩物。最常用的鹽析劑是33%~50%飽和度的硫酸銨。
(2)提取丙種球蛋白:丙種球蛋白主要為IgG(95%以上)。將35%~40%飽和度的硫酸銨沉淀物經去鹽后可直接用于某些試驗作為抗體試劑。此法簡單、穩定、固收率高,已成為免疫化學試驗的常規方法。
(3)抗原的濃縮:在液體中含量較少的抗原,如尿中的游離輕鏈及離子交換層析洗脫液中的抗原,可通過加入硫酸銨,將其沉淀下來,以利進一步純化。
鹽析法提純的抗原純度不高,只適用初步純化。
影響鹽析的因素有:
(a)溫度:除對溫度敏感的蛋白質在低溫(4度)操作外,一般可在室溫中進行。一般溫度低蛋白質溶介度降低。但有的蛋白質(如血紅蛋白、肌紅蛋白、清蛋白)在較高的溫度(25度)比0度時溶解度低,更容易鹽析。
(b)pH值:大多數蛋白質在等電點時在濃鹽溶液中的溶解度最低。
(c)蛋白質濃度:蛋白質濃度高時,欲分離的蛋白質常常夾雜著其他蛋白質地一起沉淀出來(共沉現象)。因此在鹽析前血清要加等量生理鹽水稀釋,使蛋白質含量在2.5-3.0%。
蛋白質鹽析常用的中性鹽,主要有硫酸銨、硫酸鎂、硫酸鈉、氯化鈉、磷酸鈉等。 其中應用最多的硫酸銨;另外硫酸銨分段鹽析效果也比其他鹽好,不易引起蛋白質變性。
蛋白質在用鹽析沉淀分離后,需要將蛋白質中的鹽除去,常用的辦法是透析,即把蛋白質溶液裝入秀析袋內(常用的是玻璃紙),用緩沖液進行透析,并不斷的更換緩沖液,因透析所需時間較長,所以最好在低溫中進行。此外也可用葡萄糖凝膠G-25或G-50過柱的辦法除鹽,所用的時間就比較短。
2、有機溶劑沉淀法
有機溶劑以降低溶液的介電常數,從而增加蛋白質分子上不同電荷的引力,導致溶解度降低。有機溶劑與水作用,能破壞蛋白質的水化膜,故蛋白質在一定濃度的有機溶劑中被沉淀析出。使用的有機溶劑多為乙醇和丙酮。
高濃度的有機溶劑易引起蛋白質變性、失活、操作必須在低溫下進行。
一些和脂質結合比較牢固或分子中非極性側鏈較多的蛋白質和酶,不溶于水、稀鹽溶液、稀酸或稀堿中,可用乙醇、丙酮和丁醇等有機溶劑,它們具的一定的親水性,還有較強的親脂性、是理想的脂蛋白提取液。但必須在低溫下操作。
丁醇提取法對提取一些與脂質結合緊密的蛋白質和酶特別優越,一是因為丁醇親脂性強,特別是溶解磷脂的能力強;二是丁醇兼具親水性,在溶解度范圍內(度為10%,40度為6.6%)不會引起酶的變性失活。
另外,丁醇提取法的pH及溫度選擇范圍較廣,也適用于動植物及微生物材料。
將有機溶液例如丙酮和乙醇加入蛋白質溶液時,和高濃度鹽類似產生沉淀,這是因為它們能夠降低蛋白質的溶解度。
在溫度為 10 ℃ 左右時蛋白質在有機溶劑中容易變性,所以在沉淀時必須特別注意冷卻溶液和離心轉頭(0 ℃~4 ℃ 為佳),建議離子強度為 0.05~0.2 mol/L。
注意:
1 酸性蛋白質在二價陽離子例如 Mg2+ 存在下,以復合物的形式較易被沉淀。
2. 大分子的蛋白質及親水的蛋白往往在較低濃度的有機溶劑中就能析出。
3. 在溶液 pH 值接近蛋白質的等電點時,蛋白質在有機溶液中的溶解度降低。
3、水溶性非離子型聚合物沉淀法
水溶性聚合物常用的聚合物為聚乙二醇(PEG)及硫酸葡聚糖,其沉淀蛋白質的機制尚不清楚,大致有如下解釋:
(1)聚合物與蛋白質形成共沉物;聚合物與蛋白質之間發生水的重分配;
(2)聚合物與蛋白質形成復合物。此法受許多因素影響,主要是pH、離子強度、蛋白質濃度和PEG的分子量等。分子量為2000~6000的PEG皆適宜于做蛋白沉淀用。
三、凝膠層析法
凝膠層析又稱分子篩過濾、排阻層析等。
凝膠屬于惰性載體,不帶電荷,吸附力弱,操作條件比較溫和,可在相當廣的溫度范圍下進行,不需要有機溶劑,并且對分離成分理化性質的保持有獨到之處。對于高分子物質有很好的分離效果。凝膠層析是按照蛋白質分子量大小進行分離的技術,又稱之凝膠過濾,分子篩層析或排阻層析。
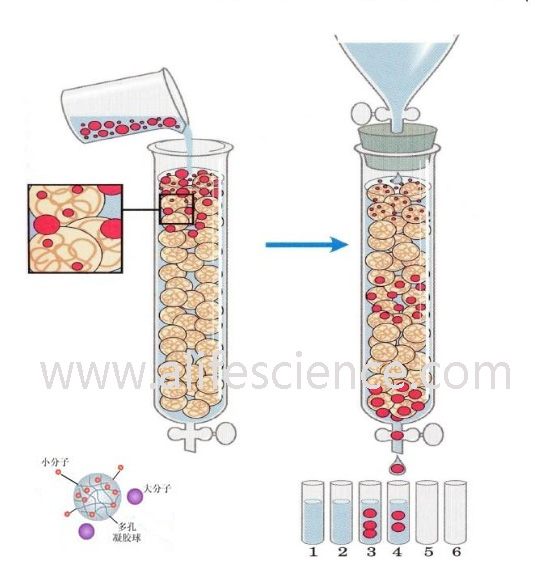
凝膠是具有三維空間多孔網狀結構的物質,樣品溶液緩慢地流經凝膠層析柱時,大分子物質不易進入凝膠顆粒的微孔,只能分布于顆粒之間,因此在洗脫時向下移動的速度較快,先被洗脫。小分子物質除了可在凝膠顆粒間隙中擴散外,還可以進入凝膠顆粒的微孔中,洗脫時向下移動的速度較慢,隨后被洗脫。因此,蛋白質分子按分子大小被分離。
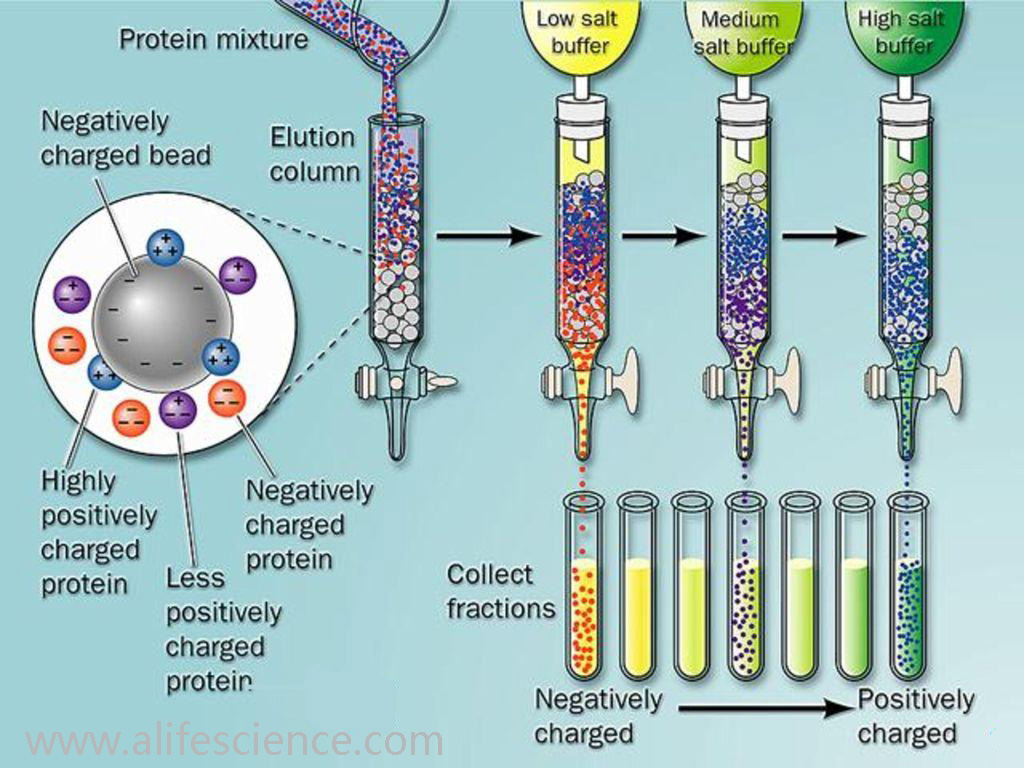
四、離子交換層析法
離子交換層析的原理是利用一些帶離子基團的纖維素或凝膠,吸附交換帶相反電荷的蛋白質抗原。由于各種蛋白質的等電點不同,所帶的電荷量不同,與纖維素(或凝膠)結合的能力有差別。當梯度洗脫時,逐步增加流動相的離子強度,使加入的離子與蛋白質競爭纖維素上的電荷位置,從而使吸附的蛋白與離子交換劑解離。
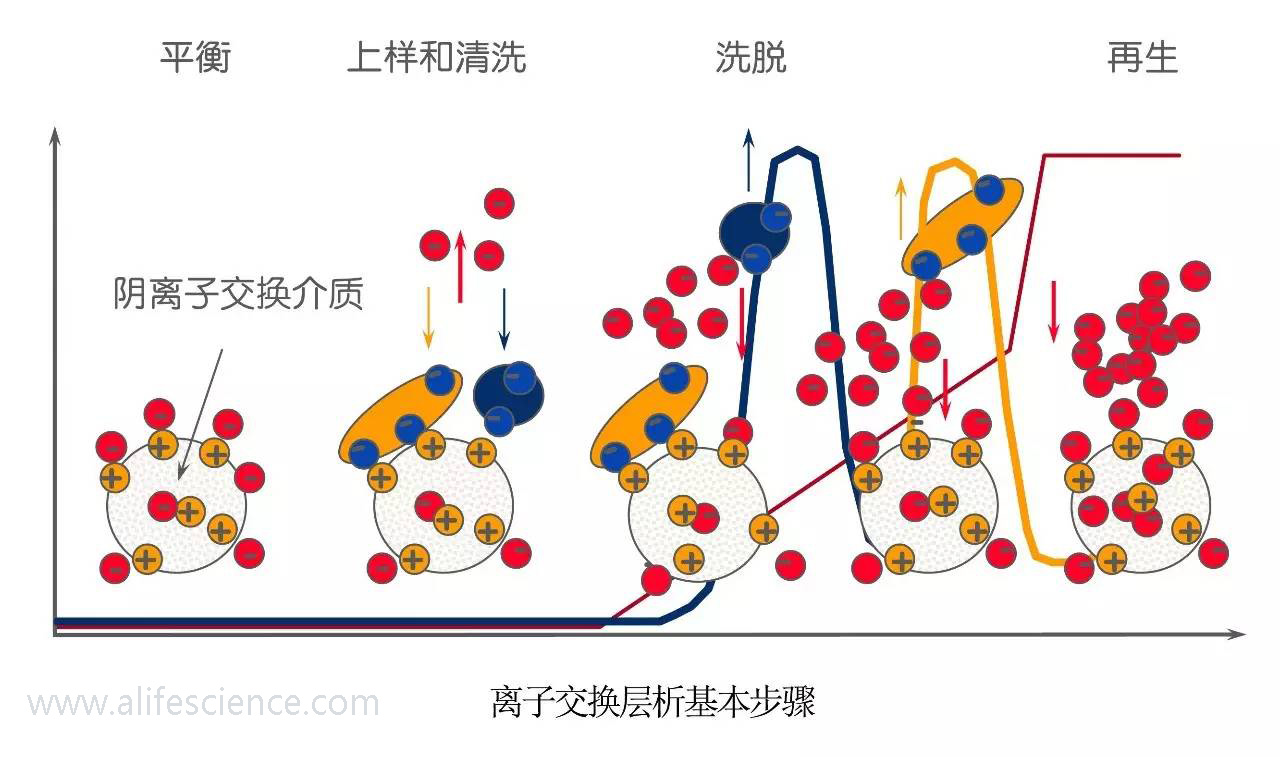
在離子交換色譜技術中常用的離子交換劑有以下幾種
①具有離子交換基團的纖維素,如羧甲基(CM)纖維素、DEAE-纖維素
②具有離子交換基團的交聯葡聚糖、瓊脂糖和聚丙烯酰胺
③凝膠合成的高度交聯樹脂。
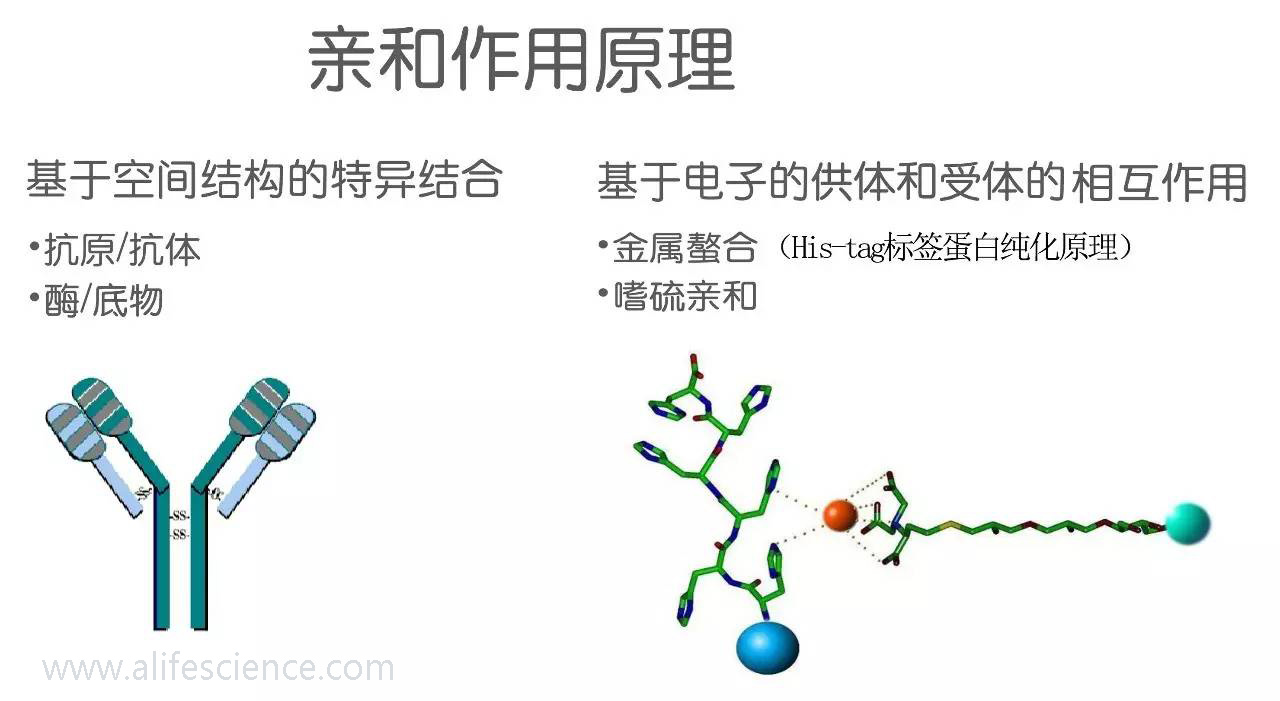
五、親和層析
親和層析是利用生物大分子的生物特異性,即生物大分子間所具有專一親和力而設計的層析技術。
例如抗原和抗體、酶和酶抑制劑(或配體)、酶蛋白和輔酶、激素和受體、IgG和葡萄球菌蛋白A(SPA)等物質間具有一種特殊的親和力。
例如提純IgG時,可將SPA吸附在一個惰性的固相基質(如Speharose 2B、4B、6B等)上,并制備成層析柱。當樣品流經層析柱時,待分離的IgG可與SPA發生特異性結合,其余成分不能與之結合。將層析柱充分洗脫后,改變洗脫液的離子強度或pH值,IgG與固相基質上的SPA解離,收集洗脫液便可得到欲純化的IgG。
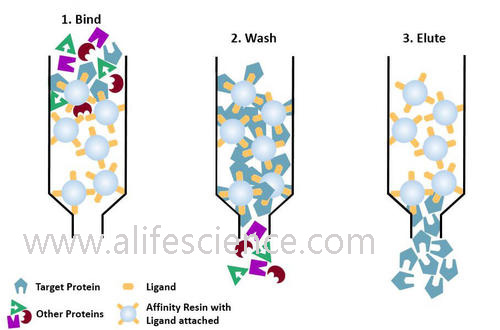
親和層析法純化蛋白質抗原的主要優點是純度高,簡單快捷,但成本較貴。
以上是蛋白提取純化的幾種常用方法,最后附上幾種蛋白層析的方法的對比
層析方法 | 親和層析 | 離子交換層析 | 凝膠過濾層析 |
分離機制 | 特異性親和 | 電荷 | 大小 |
選擇性 | 非常高 | 高 | 中等 |
載量 | 高 | 高 | 低 |
純化速度 | 高 | 高 | 低 |
生物相容性 | 好 | 好 | 非常好 |















