產品課堂
如何讓SYBR Green實時熒光定量PCR實驗MIQE起來?
應用驅動型qPCR儀選型攻略-7
SYBR Green I是科研qPCR實驗普遍使用的熒光染料。由于SYBR Green I可與包括PCR反應非特異性產物在內的所有dsDNA結合,故須在擴增結束后增加熔解曲線分析(Melting Curve analysis)以鑒別qPCR產物特異性,來驗證定量實驗結果。Tm接近的產物對熔解曲線分辨力要求極高,而實時熒光定量PCR儀的控溫性能和熒光染料屬性的不同無疑使得鑒別效力有別。有種說法是,用SYBR Green I做的qPCR實驗結果很難被牛刊編審認可。若實情如此,那melting curve analysis豈不白做?
對TaqMan熒光探針法qPCR實驗,MIQE指南要求提供實驗標準曲線方程信息、PCR擴增效率、檢測極限(LOD)以及檢測動態線性范圍。對Multiplex real-time PCR,須注明每種靶標的擴增效率和LOD值。
而SYBR Green I染料法qPCR實驗,指南規定:要有實驗陰性對照的Ct值,凝膠電泳、DNA測序、熔解曲線、擴增片段大小或DNA限制性內切酶酶切實驗來進一步檢驗PCR產物特異性[specificity must be validated empirically with direct experimental evidence (electrophoresis gel, melting profile, DNA sequencing, amplicon size, and/or restriction enzyme digestion)]。這里restriction enzyme digestion用“and/or”的表述,說明是可選項;而electrophoresis gel, melting profile, DNA sequencing, amplicon size則是必選動作。
那實際發文中,人們是如何貫徹MIQE指南的這個驗證政策的?
一、高分期刊論文中qPCR實驗SYBR Green I的使用現狀抽樣調查
我們選擇了用Viia7實時熒光定量PCR儀和SYBR Green I染料法,且實驗結果發表在IF15以上期刊的實驗案例進行了調研。
以[ViiA7[Text Word] AND PCR[Text Word] AND("0001/01/01"[PubDate] : "2021/09/30"[PubDate])]為檢索條件到3201條論文。篩選IF≥15期刊發文,對文章的正文、Supplementary Material相結合確認后,從入選37種期刊(包括了Nat Biotechnol、Nat Med、Nature、J Clin Oncol、Cell、Cancer Discov、Nat Genet、Cancer Cell、Immunity等IF30分以上刊物)中,獲得176篇article。內容涉及細胞生物學、免疫學、遺傳學、分子生物學、臨床醫學、微生物學等。再依據qPCR實驗用SYBR Green I、TaqMan探針法對文章分類計數。
表1 IF15以上期刊發表的基于Viia7系統進行的qPCR實驗論文列表(2021-09-30)
期刊 | 2021年IF | SYBR Green | TaqMan | Viia7 | 年份 |
Nat Biotechnol | 54.901 | 1 | 1 | 2 | 2015-2020 |
Nat Med | 53.443 | 5 | 7 | 10 | 2012-2020 |
Nature | 49.963 | 13 | 8 | 20 | 2013-2019 |
J Clin Oncol | 44.541 | 0 | 1 | 1 | 2016 |
Cell | 41.584 | 7 | 3 | 8 | 2016-2021 |
Cancer Discov | 39.392 | 2 | 5 | 7 | 2012-2019 |
Nat Genet | 38.333 | 2 | 3 | 4 | 2012-2019 |
Cancer Cell | 31.741 | 7 | 5 | 10 | 2013-2019 |
Immunity | 31.741 | 3 | 2 | 5 | 2017-2020 |
Circulation | 29.692 | 2 | 1 | 2 | 2017-2018 |
Nat Cell Biol | 28.824 | 2 | 4 | 4 | 2015-2020 |
Nat Methods | 28.541 | 2 | 0 | 2 | 2015-2019 |
Mol Cancer | 27.402 | 0 | 2 | 2 | 2014-2016 |
Cell Metab | 27.283 | 1 | 3 | 3 | 2017-2020 |
Cell Res | 25.611 | 3 | 0 | 3 | 2013-2019 |
Nat Immunol | 25.602 | 5 | 4 | 8 | 2012-2021 |
J Hepatol | 25.083 | 1 | 1 | 2 | 2016 |
Nat Neurosci | 24.881 | 3 | 0 | 3 | 2017-2019 |
Cell Stem Cell | 24.633 | 8 | 4 | 11 | 2017-2020 |
Blood | 22.111 | 6 | 1 | 6 | 2014- 2018 |
Alzheimers Dement | 21.562 | 0 | 2 | 2 | 2015-2018 |
Am J Respir Crit Care Med | 21.404 | 0 | 1 | 1 | 2014 |
Cell Host Microbe | 21.022 | 0 | 2 | 2 | 2016-2017 |
Ann Rheum Dis | 19.101 | 2 | 2 | 2 | 2016 |
Signal Transduct Target Ther | 18.184 | 1 | 0 | 1 | 2021 |
Mol Cell | 17.972 | 5 | 1 | 6 | 2015-2020 |
Sci Transl Med | 17.951 | 4 | 4 | 2015-2021 | |
Nat Microbiol | 17.742 | 3 | 0 | 3 | 2017-2018 |
Sci Immunol | 17.721 | 1 | 2 | 3 | 2017-2020 |
Nucleic Acids Res | 16.973 | 12 | 5 | 17 | 2013-2021 |
Adv Sci (Weinh) | 16.801 | 1 | 1 | 1 | 2013-2019 |
Mol Biol evol | 16.242 | 0 | 1 | 1 | 2014 |
Mol Psychiatry | 15.992 | 1 | 2 | 3 | 2018-2021 |
ACS Nano | 15.883 | 0 | 1 | 1 | 2021 |
Cell Death Differ | 15.823 | 8 | 7 | 13 | 2013-2020 |
eur J Heart Fail | 15.533 | 0 | 1 | 1 | 2021 |
Nat Struct Mol Biol | 15.364 | 2 | 0 | 2 | 2014-2019 |
小計 | 113 | 83 | 176 |
結果顯示:
1.1 使用SYBR Green染料法與Taqman探針的qPCR實驗文章數量分別為113篇(64.20%) 和83篇(47.16%),其中17.04%的實驗同時采用了兩種方法;
1.2 包括Nat Biotechnol、Nat Med、Nature、J Clin Oncol、Cell、Cancer Discov、Nat Genet、Cancer Cell、Immunity在內的眾多頂級影響力期刊,對使用SYBR Green I染料標記法,未顯示歧視跡象;
1.3 對176個實驗應用的“聚類”分析顯示,涉及基因表達相對定量分析、基因敲除/基因沉默驗證、基因絕對數量分析、基因分型鑒定、免疫共沉淀-定量PCR分析、miRNA調控功能分析、基因編輯與修飾水平分析、DNA損失修復機制和DNA去甲基化檢測等共10個類型。排除Multiplex多重定量PCR、SNP基因分型和臨床樣品病毒載量檢測,SYBR Green滲透入其他全部應用類型。
表2 基于ViiA7系統開展實驗應用分類表
應用類型 | 發文數量 | |
SYBR Green Assay | Taqman Assay | |
Relative gene expression analysis (RQ) (基因表達相對定量分析) | 55 | 42 |
RNAi基因沉默 (siRNA/microRNA/lnc RNA/shRNA)、敲除驗證 | 37 | 14 |
absolute copy number (AQ) (基因表達絕對定量分析) | 7 | 9 |
Gene Genotyping (基因分型鑒定) | 0 | 6 |
ChIP-qPCR assay (免疫共沉淀-定量PCR分析) | 7 | 0 |
microRNA assays (miRNA調控功能分析) | 2 | 3 |
Gene modification levels (基因編輯水平分析) | 2 | 1 |
DNA損傷修復機制 | 2 | 0 |
DNA去甲基化無亞硫酸氫鹽檢測 | 1 | 0 |
這113個用SYBR Green I染料法進行的qPCR實驗中:
針對所用引物序列提供了qPCR擴增運行協議詳細參數者,僅7篇;
明確注明所用染料的制造商、貨號者僅一例;
明確標注實驗所用儀器制造商、型號及反應模塊信息者3例。
表3 quantitative PCR assay with melting curves analysis
Reportor dye | Thermal cycling parameters | qPCR instrument | Source of the data |
PowerUp SYBR Green Master Mix (Thermo Fisher #A25742) | denaturation step 40 cycles; melting curves | ViiA7 | Daniel A. Skelly, et al. Cell Stem Cell. 2020;27(3): 459–469.e8. |
Power SYBR Green PCR Kit(Thermo Fisher) | Thermal cycling; melting curves; PCR products were separated on a 1.5% agarose gel | ViiA7 | Jong Jin Jeong, et al. Cancer Discov. 2019;9(6): 778–795. |
power SYBR green PCR mastermix(Thermo Fisher) | 50℃ - 2 min → 95℃ - 2 min; 40 cycles:95℃ - 15s → 60℃ - 1 min; melt curve analysis; sequencing the amplicons | ViiA7 or Quantstudio 5 | Smita Kulkarni, et al. Nat Immunol. 2019;20(7): 824–834 |
SYBR Green PCR Master Mix (Thermo Fisher) | 50℃ - 5 min → 95℃ - 10 min; 40 cycles:95℃ - 15s → 60℃ - 1 min; Dissociation curves (60℃- 95℃) | ViiA7 / 384-well | Chi-Fan Yang, et al. Am J Hum Genet. 2018;102(2): 219–232 |
Power SYBR Green PCR Master Mix(Thermo Fisher) | 95℃ - 10 min; 40 cycles:95℃ - 15s → 60℃ - 60s; melting analysis | ViiA7 | Mariko Kuroda, et al. J Clin Invest. 2017;127(9): 3496–3509 |
Power SYBR Green mix(Thermo Fisher) | 50℃ - 2min → 95℃ - 10min; 40 cycles:95℃ - 15s → 60℃ - 1min; melting curve analysis; Sanger sequencing. | ViiA7 | Britta Will, et al. Nat Med. 2015;21(10): 1172–1181 |
iQ SYBR Green Supermix (Bio-Rad) | 95℃ - 3min; 40 cycles:95℃ - 15s → 15s - 60℃ → 15s - 72℃; a melting curves | ViiA7 /384-well (Agilent Bravo Automate Liquid Handling Platform) | OcéaneC. B. Martin, et al. Microbiome. 2019;7: 72 |
PerfeCta SYBR green FastMix, Low ROX (Quanta Biosciences) | denaturation step:95℃ - 3min; 40 cycles:10s - 95℃ → 30s - 60℃; melting curves | ViiA7 /384-well | J Cui, W J Placzek Cell Death Differ. 2016;23(10): 1681–1690 |
SYBR Master mix | melting curves | ViiA7 | Matteo Vecellio, et al. Ann Rheum Dis. 2016;75(8): 1534–1540 |
SYBR FAST Universal 2×qPCR master mix (Kapa Biosystems) | 95℃ - 3 min; 40 cycles:94℃ - 20s → 50℃ - 30s → 72℃ - 30s; melting curves (65–95℃) | - | Phillip L. Molyneaux, et al. Am J Respir Crit Care Med. 2014;190(8): 906–913 |
對表3全部10篇文章的熔解曲線分析步驟所用染料類型及廠商信息確認結果表明,全部染料屬常規非飽和型SYBR Green I染料。
其中,Jong Jin Jeong等人用瓊脂糖凝膠電泳+熔解曲線分析兩種方法證明PCR產物的特異性。
而Britta Will等則采用熔解曲線分析和擴增子測序的驗證方法。雖仍不完全滿足MIQE指南的要求,但毋庸置疑,這個驗證流程的可信度最高。
二、HRM在qPCR中應用的特點和技術要求
DNA雙鏈長度一致的情況下,堿基互補的雙鏈熱穩定性通常要高于堿基錯配雙鏈。熔解曲線分析法是利用不同DNA雙鏈固有的Tm特征,通過均勻升高樣品溫度,使熱穩定性不同DNA由雙鏈依次熔解成為單鏈。而只能結合dsDNA的SYBR Green I在dsDNA解鏈后,從局部解鏈的DNA 分子上脫落,發射熒光信號強度隨之劇減。故通過實時檢測升溫過程熒光信號的變化,可對PCR產物中不同DNA組份進行區分。
高分辨率熔解曲線分析(High Resolution Melt,HRM)技術源于熔解曲線分析,所不同的是它需依托高分辨率熔解溫度控制裝置和飽和性DNA熒光染料的支持。
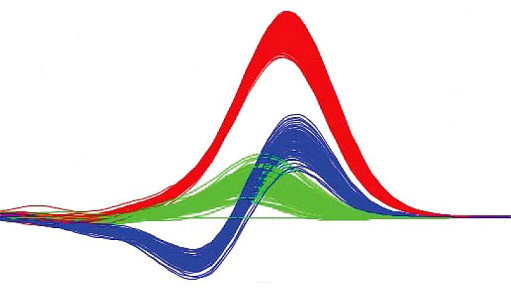
2.1 HRM分析用的飽和熒光染料
飽和熒光染料與DNA結合的特性不同非飽和熒光染料(最常用的是SYBR GreenⅠ)。高濃度SYBR GreenⅠ會抑制PCR 反應,故在熒光定量實驗中所用濃度很低,無法達到使DNA 雙螺旋小溝全部飽和結合的程度。最關鍵的是,DNA解鏈過程中,染料在從已解開的呈單鏈狀態部分片段上脫落的同時會轉到臨近的、尚未解鏈的雙鏈殘部并與之結合(結合部位重排)而繼續發射熒光。DNA雙鏈已開始熔解,但樣品熒光強度卻短暫地維持不變,監測的溶解曲線無法實時準確反應DNA解鏈狀態,對溫度分辨率降低。
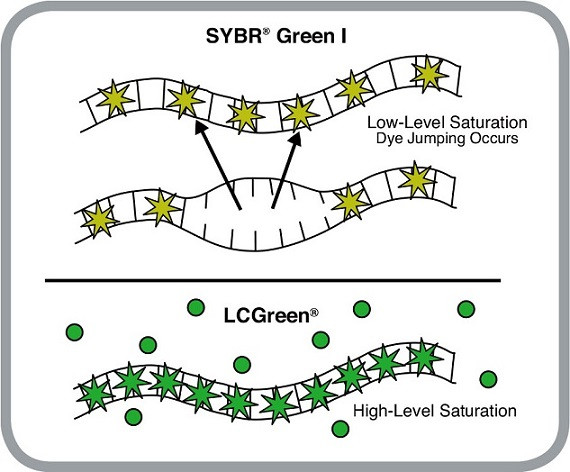
常用的飽和熒光染料有evaGreen、LC Green/LC Green Plus、SYTO 9、ResoLight等。飽和熒光染料(PCR抑制作用極其微弱可以忽略)可在DNA雙鏈中所有可結合位點分布,與DNA的結合呈飽和狀態。在雙鏈熔解過程中,尚未解鏈的雙鏈殘部已因無染料可結合位點,染料無法轉移重排而從DNA雙鏈上解離,染料熒光強度立即消失。故飽和染料溶解曲線分析熒光信號變化可以實時、準確反映DNA雙鏈隨著溫度解鏈情況,據此有效區分DNA片段堿基組成的細微差異。具有高靈敏、高分辨率的特點和善于鑒定純合型序列突變的巨大優勢。
2.2 HRM分析所需硬件支持
計算表明,單核苷酸多態性(SNP)的純合野生型(homozygous wild-type)、純合突變型(homozygous mutant)擴增子間Tm存在0.0~1.3℃不等差異。單個SNP的異源雙鏈DNA(heteroduplex)比最穩定型同源雙鏈DNA(homoduplex)的Tm低1.1-3.0℃。單堿基復合雜合突變序列(compound heterozygotes),與純合野生型序列Tm差異不過2.8–4.0℃。
? 表4 Human SNP Occurrence and Tm
SNP Class | Base Change | Typical Tm Curve Shift | Occurrence |
1 | C/T & G/A | Large(>0.5℃, average 1.0℃) | 64% |
2 | C/A & G/T | Large(>0.5℃, average 1.0℃) | 20% |
3 | C/G | Small(0.2–0.5℃) | 9% |
4 | A/T | Very small(<0.2℃) | 7% |
跨越Tm溫差范圍所需時間相對于2.2-3℃的PCR變溫速度太過短暫(最低可設定為0.050℃/s)。但早期的ABI 7700、LightCycler 1.2/2.0等實時熒光定量PCR儀的CCD數據采樣間隔高達數秒(見《實時熒光定量PCR儀檢測通道數量擴充的革命來啦?》),無法實現溶解曲線熒光信號實時采集,更遑論用于HRM分析。
在HRM技術初創時,PCR產物先以20℃/s速率被加熱到90℃,接著以相同速度冷卻到40℃以充分形成各種異源二聚體。再用高分辨率熔解曲線儀將樣品溫度以0.3℃/s的標準速率均勻升高,同時以不低于10次/℃的采樣密度監測65℃ -95℃范圍熒光信號變化。市面HRM分析儀CCD采樣頻率高達100-200次/秒。
可見,若同時進行96個樣品HRM分析,則qPCR熱循環模塊溫控精確性(≤0.3℃)、均一性(≤±0.3℃),軟件需自動調整CCD熒光數據采集頻率,以適應曲線熔解步驟數據檢測要求。
早期的實時熒光定量PCR儀,控溫精度近±0.4℃,孔間溫差高達±0.4-0.5℃,用于Tm差異2℃以上非特異性二聚體鑒別尚可,無法勝任復雜SNP檢測。
目前,包括賽默飛ViiA7、QuantStudio 1、QuantStudio 3/5、QuantStudio 6 /7 Pro、StepOne / StepOnePlus、7500 Fastreal-time PCR system,伯樂CFX96/384、CFX96/384-touch及CFX Opus 96/384real time PCR Detection system在內多款實時熒光定量 PCR儀,可用飽和型熒光染料和HRM軟件實現HRM分析功能。
LightCycler 480II是采用SimplProbe探針進行SNP分型鑒定。
三、關于SYBR Green染料法在qPCR實驗中應用的思考
3.1 SYBR Green I單峰勢單力薄
SYBR Green I最早僅限用于Tm相差超過2℃ PCR擴增片段的鑒別。
對在囊性纖維化基因I507/F508區域擴增產物的熔融曲線實驗也證實,相同片段,SYBR Green I測得的Tm值比采用5 –熒光標記引物對照組高2℃。對長度41-44 bp的雜合樣本的熔解曲線分析結果顯示,5 –熒光標記引物組圖出現了與預期一致的兩個同源雙鏈產物+兩個異源雙鏈產物峰。而SYBR Green I標記組每個基因型只有一個同源雙鏈產物峰。
說明,不同基因型擴增產物Tm差異減小會使SYBR Green I分辨力喪失,產物特異性驗證失效。憑SYBR Green I染料熔解曲線單峰表現,斷言qPCR擴增的特異性顯然不夠。
3.2 HRM高分辯曲線亦須審慎
基因組水平上單堿基突變引起的DNA 序列多態性,有同型堿基之間(G-A或T-C)的轉換、嘌呤與嘧啶(A-T、A-C、C-G、G-T) 之間的顛換、單個堿基插入和堿基缺失4大類型。顛換純合突變片段Tm值存在0.8~1.4℃的差異。但轉換純合突變片段間的Tm值區別極其細微(通常<±0.4℃),甚至qPCR儀用HRM分析難以分辨。
此外,隨著擴增片段長度增加,HRM檢測靈敏度和特異性降低。對于僅1-2 bp堿基差異大片段分型時,HRM技術分辨率是不夠的。
對復雜遺傳背景擴增產物特異性驗證的可信性,HRM技術與TaqMan熒光探針是有差距的,不可同日而語。
3.3 MIQE指南所言入木三分
正因為SYBR Green I熒光染料標記技術的固有缺陷,業內對其在qPCR實驗的應用保持謹慎的態度。MIQE指南在引物和探針序列經BLAST分析驗證、擴增結束引入熔解曲線分析基礎上,要求對qPCR產物特異性引入凝膠電泳甚至基因測序實驗確認。但時至今日,學界對MIQE指南規定的qPCR實驗結果驗證的技術方法意見依然不統一。
SYBR Green I、LC Green、evaGreen、SYTO 9等熒光染料標記法對于qPCR實驗,當用盡用,毫無疑問。
熔解曲線或HRM分析之外增加PCR產物凝膠電泳條帶專一的驗證,確是MIQE力挺的。雖有可能招來“沒必要”這類善意“中評”,但應祝賀!因為實驗者對qPCR驗證的思想境界顯然已對標Cancer Discov刊文作者啦!
參考文獻
[1]Stephen A. Bustin, Vladimir Benes, Jeremy A. Garson, et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry, 2009;55:4611–622
[2]譚昌淵,羅九甫,任兆瑞.高分辨率熔解曲線分析—分子診斷的新技術.生命科學研究, 2009,13(3):268-271
[3]Cameron N. Gundry, Joshua G. Vandersteen, Gudrun H. Reed, et al. Amplicon Melting Analysis with Labeled Primers:A Closed-Tube Method for Differentiating Homozygotes and Heterozygotes. Clinical Chemistry,2003;49(3):396–406
[4]Luis B. Barreiro, Ricardo Henriques, Musa M. Mhlanga. High-Throughput SNP Genotyping: Combining Tag SNPs and Molecular Beacons. Single Nucleotide Polymorphisms. 2009; 578: 255–276.
[5]ABI PRISM 7700 Sequence Detection System User′s Manual(904989B,01/2001)
[6]Robert Graham, Michael Liew, Cindy Meadows,et al. Distinguishing Different DNA Heterozygotes by High-Resolution Melting.Clin Chem. 2005;51(7):1295-8
[7]A Guide to High Resolution Melting (HRM) Analysis(Thermo Fisher)















