產品課堂
實時熒光定量PCR反應雙溫循環法的合理性及局限性
應用驅動型qPCR儀選型攻略-5
常規PCR擴增實驗的反應過程無法監測,只有PCR反應結束后,通過凝膠電泳條帶圖像分析、Southern Blot等方法,可對擴增終產物進行定性及定量分析。因此,相對于實時熒光PCR,人們把常規PCR稱為終點PCR (Endpoint PCR)。終點PCR擴增程序通常由經典的變性-退火-延伸三個溫度步驟循環組成。
適宜退火溫度可確保產物擴增特異性和擴增產能。而有種說法是,PCR反應的退火溫度與最適宜溫度條件差1℃,會造成非特異性產物的含量升高4倍。故人們歷來對PCR反應退火溫度的選擇、退火和延伸步驟時長的設置慎之又慎。
但實時熒光定量PCR實驗的情況似乎不一樣。擴增片段長短、引物序列組成和長度差異形形色色,但不管起始模板是cDNA還是基因組DNA,報告熒光基團是SYBR Green I抑或TaqMan探針與FRET雙雜交探針,取材來自動植物、微生物抑或臨床組織樣品,是進行單重熒光檢測還是multiplex多重熒光分析,反應條件經常是95℃- 60℃兩個溫度循環40次的程序設置。給人感覺:PCR擴增條件按實時定量PCR用60℃標準溫度就可以,優化引物退火溫度多此一舉,可以休矣。
表1 two-temperature PCR protocols
反應類型 | PCR熱循環條件 | 備注 | 文獻出處 |
endpoint PCR | 1 min - 95℃→ 1 min - 58℃→ 1 min - 72℃ 25 cycles | - | Magdalena C Liebl, et al. Nucleic Acids Res. 2021; 49(5): 2759–2776 |
RT-qPCR | 95℃ - 5 min; 95℃ - 5 s → 60℃ - 30s,40 cycles | SYBR Green I dye LightCycler 480 or CFX384 Touch Real-Time PCR System | |
RT-qPCR | 3 min - 95℃ 95℃ - 15 s →60℃ - 45 s,40 cycles | SYBR Green I dye CFX96 Real-Time PCR System | Zheng-Wei Fu, etal. Nucleic Acids Res. 2021; 49(4): 1886–1899 |
RT-qPCR | 95℃ - 10 minutes; 95℃ - 15 s → 60℃ - 60s,40 cycles | SYBR Green I dye ViiA7 Real-Time PCR System | Ross J Hill, et al. Nat Genet. 2019; 51(8): 1283–1294 |
95℃ - 10 minutes; 95℃ - 15 s → 60℃ - 60s,40 cycles | TaqMan probes ViiA7 Real-Time PCR System | ||
RT-qPCR | 50℃–2min → 95℃ - 10min; 95℃–15sec → 60℃- 1min,40 cycles | SYBR Green I dye or TaqMan Probe ViiA7 Real-Time PCR System | Britta Will, et al. Nat Med. 2015; 21(10): 1172–1181 |
Duplex | 50℃- 2min → 95℃- 10min; 95℃ - 15s →60℃ - 60s,40 cycles | ViiA7 Real-Time PCR System | Luca Perico, et al. Nat Commun. 2017; 8: 983 |
Duplex | 95℃- 10 min; 15s - 95℃ → 60s - 60℃,40 cycles | ViiA7 Real-Time PCR System | Scott Gettinger, et al. Cancer Discov. 2017; 7(12): 1420–1435 |
triplex | 30 min - 42℃, 10 min - 95℃; 95℃ - 15s → 58℃- 45s,40 cycles Plate-reading during the 58℃ phase | 7300 Real-Time PCR System | Roujian Lu, et al. Lancet. 2020 22-28; 395(10224): 565–574 |
triplex | 50℃ - 2 min, 95℃ - 10 min; 95℃ - 15sec → 60℃ - 60s,40 cycles | TaqMan probes Real-Time PCR System | Matthias Lübbert, et al. Neuron. 2019; 101(2): 260–273.e6 |
triplex | 94℃ - 10 min; 94℃ - 30s → 62℃ - 45s,45 cycles | LightCycler 480 Real-Time PCR System | Yongqing Tong, et al. J Exp Clin Cancer Res. 2018; 37: 68 |
triplex | 95℃- 20s; 95℃- 1s → 60℃- 20s,40 cycles | StepOnePlus Real-Time PCR System | Karolina A. Rygiel, et al Nucleic Acids Res. 2016; 44(11): 5313–5329 |
quadruplex | 94℃- 10 min; 94℃ - 15s→60℃ - 60s,40 cycles | QuantStudio 6 Flex Real-Time PCR System | Christian Gaebler, et al. J Exp Med. 2019; 216(10): 2253–2264 |
endpoint PCR | 95℃ - 3 min; 95℃ - 30s →68℃-30s→72℃-30s,35 cycles;5 min - 72℃ elongation | - | Behnoush Hosseini, et al. PLoS One. 2021; 16(9): e0257225 |
quadruplex | 95℃- 3 min; 95℃ - 15s → 60℃ - 45s,40 cycles | SensiFAST Probe CFX96 Real-Time PCR system |
同是進行DNA序列熱循環擴增,為何實時熒光定量PCR儀放棄成熟的變性-退火-延伸三溫循環法,啟用95℃-60℃兩個溫度循環反應程序?這個貌似 “標準化”的PCR protocol從何而來,是TaqMan探針擴增必然要求,還是受熒光信號檢測技術所限不得已而為之?沒有雙溫循環法qPCR還能做嗎?
一、雙溫度循環 PCR程序源自ABI早期TaqMan探針應用經驗
如《實時熒光定量PCR儀熒光檢測技術融合趨勢雜談》所述,是ABI為TaqMan探針技術落地與應用創建了一整套標準體系,并在ABI PRISM 7700 Sequence Detection System原型機上驗證成功。這套體系包括了Primer Express software工具軟件、引物探針設計法則、探針檢測PCR反應條件等內容。
將退火、延伸步驟整合,并用低于探針Tm的溫度作為退火-延伸共享溫度(combined annealing/extension temperature)這一方法,可兼顧引物與模板復性與延伸、探針與模板穩定雜交和探針5′端的水解這些關鍵環節的技術要求。同時,通過優化反應體系中MgCl2濃度,保持探針在較高溫度下的雜交穩定性,盡可能地提升AmpliTaq Gold酶合成效能。據此確立了由95℃變性和55℃-62℃退火/延伸1分鐘兩個溫度循環的qPCR擴增程序( two-temperature PCR protocol)。
在正式ABI PRISM 7700熒光定量PCR儀的運行編程初始模板中,為TaqMan探針定制的熱循環條件是:
HOLD階段:10 min,95℃
CYCLE階段:Melt step 95℃ - 15 sec,Anneal/Extend step:60℃ - 1 min, 40 Cycles.
其雙溫循環(two-temperature cycle)包括了一個95℃長15秒的雙鏈熔解(變性)溫度步驟 (denaturation or melting step)和一個60℃長1分鐘的退火-延伸步驟(anneal-extension step)。
眾所周知,實時熒光定量PCR儀與終點PCR儀運行機制的最大區別是實時采集每一輪熱循環中的熒光信號。ABI確定以退火-延伸步驟采集的TaqMan探針熒光數據作為分析依據。
為了確保熒光數據采集的準確性,7700系統將經典PCR三溫度循環中引物退火和延伸兩步合并為退火/延伸一步,這樣設計是便于延長共享溫度步驟的維持時間,目的是給CCD的多點熒光數據采集提供足夠周轉時間(可參《實時熒光定量PCR儀檢測通道數量擴充的革命來啦?》)。
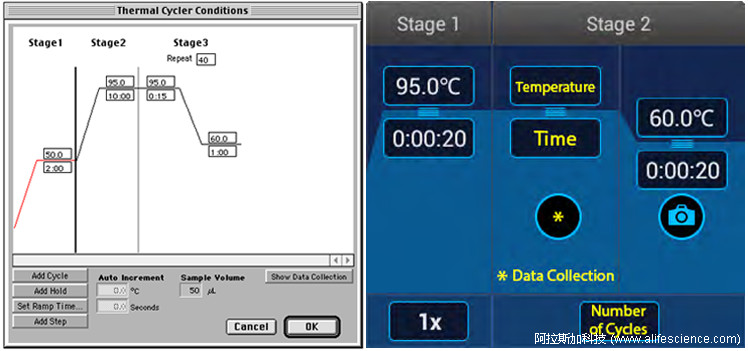
從7700到隨后的7300、7500、StepOnePlus,從Viia7到Quantstudio 5、Quantstudio 6 Pro、Quantstudio 7 Flex,初始編程模板始終是雙溫循環設置,所不同的只是退火-驗收步驟中時間長短有變化。
ABI處心積慮、另辟蹊徑開發這一檢測方法,是為從TaqMan探針應用技術專利中切自己那份蛋糕。這毋庸置疑,也合情合理。
用ABI技術和質控標準下的商品化引物、TaqMan探針試劑和雙溫循環法擴增,多數情況下,均可獲得良好擴增效果。憑借ABI在實時熒光定量PCR儀領域的領導地位,TaqMan探針檢測擴增程序因qPCR儀推廣而迅速普及。
人們照貓畫虎,將TaqMan探針實驗擴增方法拓展到SYBR GRREN I檢測中并取得成功,從而造就了如今雙溫循環法漫天飛舞的盛景。
二、雙溫度循環擴增法并非法定qPCR實驗標準
資料表明,95℃-60℃兩步溫度循環程序并非正式行業標準。眾多實時熒光定量PCR儀廠商也沒有將其引入系統初始Protocol設置。
羅氏是TaqMan探針5′nuclease assay技術、PCR核心方法專利所有者,但LightCycler系列定量PCR儀的experiment protocol設定環節,program(步驟)、temperature Target(目標溫度)和hold time參數都是開放的。
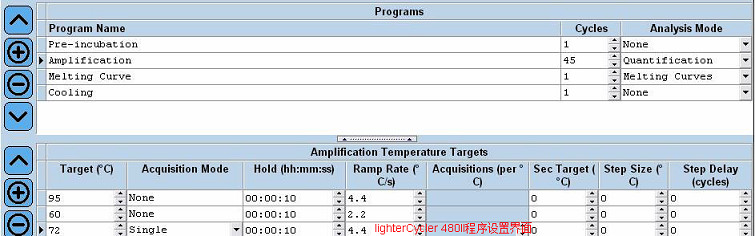
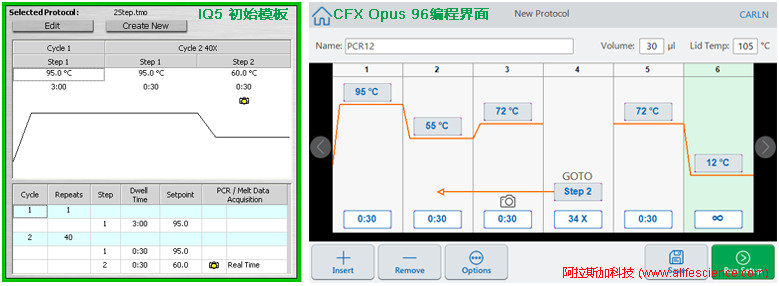
伯樂Icycler IQ系統在運行設置初始模板中曾引入了雙溫循環設置。但從CFX 96開始,如CFX 96-Touch、CFX Opus 96實時熒光定量PCR儀等,系統運行編程界面已恢復到用戶自主設定PCR反應步驟和溫度的界面模式。
Agilent Stratagene MX3000P、Mx3005P運行設置中,初始模板用的依然是95℃變性-55℃退火-72℃延伸的經典三溫循環編程設置。
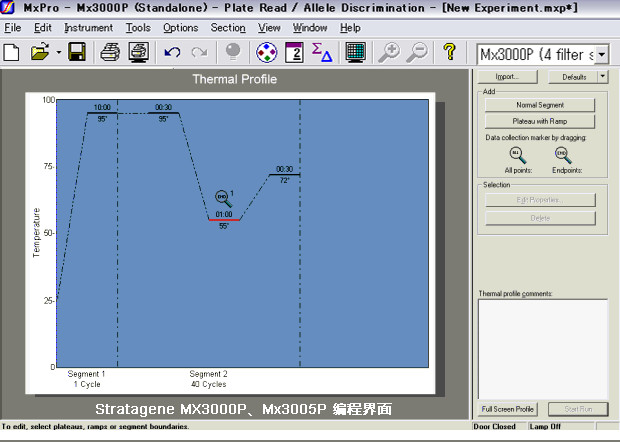
這說明,qPCR實驗中,雙溫循環擴增法的應用在業內并未完全取得一致,是有保留的。
三、實時熒光定量PCR反應雙溫循環法的合理性及局限性
TaqMan熒光探針信號檢測是基于5′核酸酶降解與模板結合DNA的原理。PCR反應條件須同時滿足四個要素:
1)引物與模板穩定結合并得以正常延伸;
2)探針與模板結合才能被降解,故PCR延伸過程須在確保探針特異性結合的溫度下進行;
3)引物的延伸順利延伸至探針5′端;
4)探針被切除釋放熒光信號。
qPCR技術創立早期實驗證明,當擴增片段較小,且引物退火溫度與延伸溫度相差不超過3°C情況下,95℃的變性步驟不變,而退火、延伸兩步合并為60℃一步的改良可行。
與此同時,可以發現該方法的以下特征:
特征1 酶活性不夠時間補
60℃明顯低于70-72℃的AmpliTaq金牌酶活性最佳溫度范圍。聚合酶活性降低會造成引物延伸效能下降,用的是延伸時間適度延長的辦法予以彌補。
特征2 溫度高了MgCl2頂
60℃可能比引物-模板特異性結合溫度高,通過改進PCR反應組份引物濃度和優化體系組份的方法可以克服。而此溫度條件無疑有助于限制非特異性擴增產物出現,增加PCR反應的特異性。
特征3 以效率代價換專利
雙溫循環法qPCR擴增程序本質上是赤裸裸地以犧牲PCR擴增效能為代價,來換取TaqMan熒光探針檢測技術專利的確立。但技術上總歸是有缺陷的。
從表1 Behnoush Hosseini等報道的實驗數據可以看出,完成同一個片段的擴增,終點PCR實驗采用三溫循環法只需35個循環即可達到擴增產物檢測用量要求,而在qPCR的雙溫循環法擴增要40個循環才能出現陽性結果。
人們其實早就認識到,雙溫循環法有其明確“適用癥”限制,它并非包治百病適用于所有靶片段擴增。譬如于長片段樣品,雙溫循環法存在擴增效率低、穩定性和重復性差的問題。有相當一部分實驗采用雙溫循環擴增方法存在困難,且不容易通過優化反應條件、加長延伸時間有效克服。原因可能是兩步循環擴增法常用的退火、延伸的溫度和時間設置影響了引物的擴增效果有關。
在對白酒發酵菌Lactobacillus sp.的一段445 bp片段的熒光PCR對比實驗表明,采用傳統變性、退火、延伸三步循環擴增法,擴增結果穩定性高,擴增線性強,檢測靈敏度高。
結果顯示,三溫循環擴增法每個循環時間僅多出25s,加上從55℃退火→ 72℃延伸升溫過程耗時(按4℃/s變溫速率計算),完成40個循環擴增總耗時比雙溫循環法多出不過20分鐘而已。對符合科研假說的完美陽性結果孜孜以求的科研人員來說,20分鐘實驗延時有那么難以忍受嗎?何況,若采用表1文獻中大部分兩步法擴增退火/延伸時間維持45s-60s重新評估,單次循環中兩種擴增法耗時差距縮短至10s,完成兩種實驗程序時長差距將無足輕重。
表2 實時熒光定量PCR實驗中三步溫度循環擴增程序
反應類型 | PCR熱循環條件 | 備注 | 文獻出處 |
RT-qPCR | 95℃ - 20 s → 60℃ - 20 s → 72℃ - 20 s 45 cycles | SYBR Green I dye Lightcycler 480 II Real-Time PCR System | Seungwoo Cha, et al. Nucleic Acids Res. 2021; 49(2): 745–759 |
RT-PCR | 95℃ - 3 min; 98℃ - 10 s →60℃ - 30 s →72℃ - 6 min 22 cycles | - | Minoru Kubo, et al. Nucleic Acids Res. 2019; 47(9): 4539–4553 |
endpoint PCR | 98 ℃ 1 min 98℃- 10s → 55℃ - 30s → 72℃ - 25s,40 cycles | - | 杜如冰,等. 微生物學通報, 2020, 47(1): 1-12. |
qPCR | 98 ℃ 1 min 98℃ - 10s → 60℃ - 30s,40個循環 | SYBR Green I dye ABI Real-Time PCR System |
即便是雙溫循環法的qPCR實驗,也并非千篇一律用95℃、60℃這兩個循環溫度。部分論文中采用的是變性94℃、退火延伸58℃方案(見表1)。
實際上,市面部分實時熒光定量PCR探針 (TaqMan,Molecular Beacon等)用的預混試劑,因60℃會抑制所用的熱啟動酶活性,擴增只能采用三步溫度循環法進行。
四、小結
實時熒光PCR實驗與普通終點PCR,無論是否加入熒光染料、熒光探針檢測,本質都離不開對靶序列的高效、特異性擴增,故經典變形-退火-延伸三個溫度步驟循環法,都是適用的。
95℃變性-60℃退火/延伸雙溫度循環法,是人們遵從體外PCR客觀規律基礎上、在巨大商業利益驅動下催生的。應秉持科研探索精神,取其精華去其糟粕,正視其特殊應用價值,但不可一葉障目并為之自縛手腳。
參考文獻
[1]ABI PRISM 7700 Sequence Detection System User′s Manual(904989B,01/2001)
[2]LightCycler 480 Instrument Operator’s Manual Software Version 1.5
[3]CFX Opus 96 and CFX Opus 384 Real-Time PCR Systems Instrument Guide
[4]MxPro QPCR Software Instruction Manual For Mx3000P and Mx3005P QPCR Systems(Software version 4.10)
[5]杜如冰, 吳群, 徐巖. 基于三步熒光定量PCR技術揭示不同產區白酒釀造系統中Lactobacillus sp.的分布特征. 微生物學通報, 2020, 47(1): 1-12.















